بیماری تاولی خوکSwine vesicular disease (SVD)

تعریف:
بیماری تاولی خوک یک ناخوشی ویروسی مسری حاد خوک سانان بوده که توسط اینتروویروس ها ایجاد می شود . بیماری با بروز تب و ظهور تاول هایی زخمی شونده در دهان و بر روی بینی ، پا ها و سرپستانک ها مشخص می گردد . عامل بیماری در برابر گرما نسبتاً مقاوم بوده و قادر است مدت زمان طولانی را در نمک ، خشکی و محصولات دودی گوشت تحمل نماید . این ناخوشی نشانه های بالینی تقریباً همسانی با بیماری تب برفکی داشته اما تنها در خوک های تظاهر می نماید . بدلیل خسارات اقتصادی فراوان این بیماری در صنعت پروش خوک توجه به آن حائز اهمیت است .
تاریخچه بیماری:

بیماری برای اولین بار درایتالیا گزارش گردید (1966)، و بعد ها در هونگ کونگ ، ژاپون و شماری از کشور های اروپائی شناسایی شد . ایتالیا ، اسپانیا و پرتغال به سال 1990 شاهد همه گیری های از بیماری بوده اند.امروزه بیماری در ایتالیا به حالت بومی درآمده . گمانه زنی های بسیاری در خصوص منشاء این بیماری به ظاهر جدید وجود دارد ، و برخی از گزارش های آزمایشگاهی این فرضیه را تقویت می کند که عامل بیماری ویروسی جدید بوده و ظاهراً از اینتروویروس های انسانی مشتق گردیده . اولین همه گیری بیماری به سال 1972 از بریتانیا گزارش شده ، در طی 10 سال بعد 532 مورد همه گیری مشتمل بر ابتلای 322081 مورد خوک پیش از ریشه کنی بیماری (1982)از این کشور گزارش شده است . در سال 2007 بغیر ایتالیا که بیماری در آن بومی شده سایر بخش های اروپا بجز یک مورد ابتلای در پرتغال عاری از بیماری تلقی می شوند .
سبب شناسی :
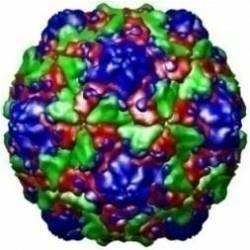
ویروس عامل این بیماری (SVDV)[1]متعلق به خانواده پیکورناویریده و جنس اینتروویروس ها بوده و در ارتباطی نزدیک با اینتروویروس کوکساکی B-5 (CVB5)انسانی می باشد . همچنین این ویروس تعلقی به اینترو ویروس های شناخته شده خوک سانان ندارد . بنا بر نظر برخی از محققین و براساس ارتباطات پادگنی و مولکولی بین SVDV و CVB5 ویروس این بیماری از زیراعقاب ژنتیکی CVB5 است که در بین سال های 1945 و1965 پدیدار گردیده و تصور می شود که ویروس فوق ناشی از انتقال ویروس های انسانی از طریق مدفوع به خوکها است . ویشه ویروسی کروی خشن با قطر 28 نانومتری و ژنوم RNA تک رشته ای است . ژنوم برهنه ویروس توسط یک پوسته پروتئینی احاطه گردیده . پوشینه (کپسید)ویروس متشکل از 60 پیش پاره [2] بوده که هر کدام از این پیش پاره ها از 4 پلی پپتید به نام های VP1،VP2 ، VP3و VP4 ساخته شده اند. پلی پپتید VP4 در سمت داخلی پوشینه قرار دارد .
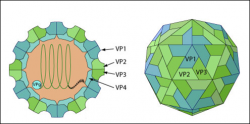
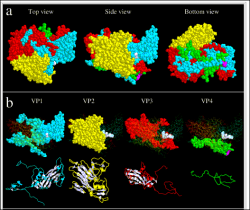
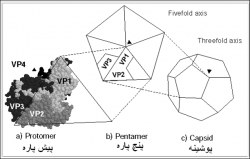
ژنوم خطی یک قسمتی ویروس از نوع RNA تک رشته ای پلی آدنیله به طول 8/5 تا 2/7 کیلو باز(5800 تا7200 نوکلئوتید) بوده و متشکل از یک ORF رمز گذاری شده برای یک پلی پروتئین می باشد . RNA ژنوم ویروس دارای یک پروتئین ویروسی (VPg) در انتهای ′5 بجای یک ساختار کلاهکی متیل دار است . ناحیه غیر ترجمه ای (UTR) طویل در انتهای ′5 حاوی یک جایگاه ورود ریبوزومی داخلی(IRES)[3] نوع یک است .ناحیه P1 پلی پپتید های ساختاری را رمزگذاری می نماید . ناحیه P2 و P3 پروتئین های غیر ساختاری ملازم همانند سازی را رمزگذاری می کنند . همچنین در این نواحی پروتئازهای 2A و 3C رمزگذاری شده اند . بخش غیر ترجمه ای ژنوم (UTR) در تولید رشته منفی ژنومی دخیل است .
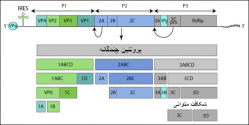
RNA ویشه ویروسی عفونت زا بوده و ایفاگر نقش ژنومی و RNA پیام رسان ویروسی است . IRES اجازه ترجمه مستقیم پروتئین چندگانه[4] را مهیا می سازد . در آغاز پروتئین چندگانه تولید شده توسط پروتئاز های ویروس به سه پروتئین پیش ساز P1 ، P2 و P3 تبدیل می شود . سپس پروتئین پیش سازP1 بطور پروتولیتیک شکسته شده و پروتئین های ساختاری را بوجود می آورد . پروتئین های پیش ساز P2 و P3 نیز بدین صورت فرآوری شده و به ریپلیکاز ، VPg و شماری از پروتئین های تغییر دهنده یاخته میزبانی تبدیل می شوند ،رخداد های فوق سرآنجام منجر به تجزیه و تلاشی یاخته آلوده می شوند .
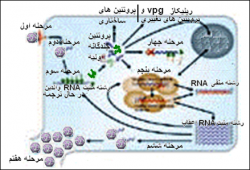
چرخه همانند سازی ویروس داخل سیتوپلاسمی بوده و شامل مراحل زیر می باشد :
1) ویروس به گیرنده های میزبانی اتصال یافته و تشکیل حفره پوشاننده را میدهد . شواهد نشان می دهد که SVDV به شدت با پروتوگلیکان هپارین سولفات که از عمده ترین اجزای سطحی یاخته ای است واکنش داشته و اولین مرحله اتصال ویروس به یاخته را ممکن می نماید . در مرحله بعدی ویروس به گیرنده های CAR [5] که یک گلیکوپروتئین 46 کیلودالتونی است و DAF [6] (بنام CD55 نیز معروف است) پیوند می یابد .
2) پوشش زدائی ویروسی محقق شده وRNA ژنومی ویروس احتمالاً از طریق تشکیل منفذی در غشای یاخته میزبان بداخل سیتوپلاسم یاخته میزبان رها می شود .
3) VPg از RNA ویروسی حذف شده و متعاقباً با شروع روند ترجمه، پلی پروتئین ویروسی تولید می شود .
4) در اثر پروتئاز 2A ویروس عامل آغازکننده روند ترجمه eIF4G متلاشی شده و از این طریق روند ترجمه وابسته به کلاهک یاخته میزبانی متوقف می گردد.در حالی که روند ترجمه غیروابسته به کلاهک ویروس ادمه خواهد داشت.
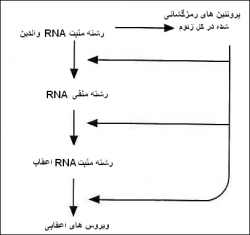
5) روند همانند سازی RNA ویروس بر روی غشای حفرات مشتق از شبکه اندوپلاسمیک محقق می شود . RNA تک رشته ای مکمل باقطبیت منفی با استفاده از RNA ژنومی بعنوان الگو ، تولید می شود .
6) درتولید RNA ژنومی جدید (اعقاب)RNA با قطبیت منفی همچون الگویی بکاررفته و اعتقاد بر این است که این RNA های ژنومی تولید شده در پوشینه های اولیه تشکیل شده متراکم می گردند.
7) یاخته آلوده متلاشی شده و ویروس ها رها می شوند .
8) ویشه های اولیه (نارس) توسط پروتئاز های میزبانی بالغ می شوند .
علارغم وجود یک نوع سرمی ، ویروس این بیماری تنوع پادگنی و ژنتیکی بالایی را دارد . بواسطه تجزیه و تحلیل توالی نوکلئوتیدی پروتئین های پوشینه ویروسی و تعین معیار پادگنی مربوطه بیش از 100 اشتقاق ویروسی از اروپا و ژاپون گزارش گردیده . این اشتقاق ها در چهار گروه طبقه بندی می شوند . گروه های 1 و 2 بیش از دیگر گروه های (3 و4 که اخیراً کشف گردیده اند) به یکدیگر نزدیک هستند .
این عامل بیماری زا در برابر گستره PH وسیعی (5/2 تا 12) مقاوم بوده ، نسبتاً در برابر حرارت(در دمای 69 درجه سانتی گراد) پایدار است و در دمای 56 درجه سانتی گردا طی یک ساعت غیر فعال می شود و در محیط حاوی نمک (تا 2 سال ) ، در خشکی و محصولات گوشتی دودی شده مدت طولانی ماندگار است . ویروس در برابر تخمیر مقاوم بوده و در ران خوک نمک زده به مدت 180 روز ، در سوسیس بیش از یک سال و در فرآورده های روکش دار روده ای تا بیش از 2 سال باقی می ماند . ویروس را می توان در حضور مواد آلی با هیدرو اکسید سدیم 1٪ غیر فعال نمود . در فقدان حضور مواد آلی از ضد عفونی کننده های چون عوامل اکسیدان ، ترکیبات یدوفور ، اسید ها و غیره ...که سازکاری با مواد پاک کننده دارند می توان استفاده کرد . دمای یخچای و انجماد موجب حفظ ویروس می شود.
همه گیر شناسی:
بیماری برای اولین بار در ایتالیا دیده شده و متعاقباً از هونگ کونگ ، انگلستان ، اسکاتلند، والز، ژاپن ، مالت ، استرالیا ، بلژیک ، فرانسه هلند ، آلمان ، لهستان ، سویس، یونان و اسپانیا گزارش گردیده . اگر چه بیماری از همه کشور های اروپایی ریشه کن شده ولی هنوز در کشور های خاور دور حضور دارد .
خوک تنها میزبان طبیعی برای این ویروس بوده و بچه موش را می توان بطور تجربی آلوده ساخت . افراد انسانی که در آزمایشگاه کار می کنند امکان ابتلای اتفاقی دارند .
آغاز بیماری در یک گله با تغذیه از زباله های حاوی تکه گوشت های آلوده ، با ورود حیوانات آلوده یا بواسطه تماس مستقیم با مدفوع آلوده محقق می شود . پس از شروع آلودگی بیماری از طریق تماس خوک ها حساس با خوک های بیمار یا مدفوع آلوده در گله منتشر می گردد. ویروس به راحتی از طریق ضایعات پوستی و مخاطی قابلیت عفونت زایی دارد . مدفوع آلوده اصلی ترین منبع انتشار ویروس بشمار می رود . بروزهمه گیری های اخیردر اروپا پس از ورود خوک هایی که نشانه ای از بیماری نداشته و در واقع به شکل تحت بالینی مبتلا بوده اند ، محقق شده است . خوک های بیمار ویروس را از طریق بینی ، دهان و مدفوع تا 48 ساعت پیش از ظهور نشانه های بالینی به خارج دفع می نمایند . ویرس در مدفوع خوک آلوده تا سه ماه پس از آلودگی به محیط وارد می شود .
SVDV مدت زمان طولانی را در محیط خارج از بدن دام تحمل کرده و پایدار می ماند . همچنین ویروس موجود در بافت های لنفاوی گوشت خشک ، نمک سود شده و دودی قادر است تا دو سال پایداری داشته باشد . مجاری روده اولین جایگاه عفونت بوده و تمامی بافت های بدن دام در طی مرحله انتشار خونی آلوده به ویروس هستند . بافت پوششی تاول ها ، مایعات تاولی ، مدفوع و خون دام های بیمار از منابع بالقوه انتشار ویروس محسوب می گردند .
میزان واگیری بیماری اندک بوده واز آن بعنوان یک بیماری نسبتاً مسری یاد می شود . ضایعات ناشی از این بیماری در مقایسه با تب برفکی کمتربوده و اساساً بیماری تلفاتی را در بر ندارد .
روند بیماری زایی:
اساساً اینتروویروس ها قابلیت تکثیری وتزایدی در بافت پوششی بینی- حلقی و غدد لنفاوی موضع یاد شده را دارند ، همچنین ویروس در ملتحمه ، روده ، عقده های روده بند و سامانه مشبک درون پوش عروقی [7] نیز عفونت آفرین می باشد .ویروس این بیماری گرایش زیادی به بافت های پوششی زبان ، پوزه ، نوار تاجی سم و لب ها ، عضله قلب و اجزای لنفاوی لوزه و قاعده مغز دارد . بافت های پوششی ابتداعاً درگیر می شوند که در این بین یاخته های پوششی طبقه خار دار پوست و زبان یاخته های هدف اولیه این ویروس هستند . بدنبال آن عفونت عمومی در بافت های لنفاوی پدیدارگردیده و متعاقباً انتشار خونی ویروس محقق می شود . با ورود ویروس از مسیر دهان و بینی روند عفونت زایی و تکثیر ویروس در بافت پوششی بینی -حلقی و بافت های لنفی موضعی خصوصاً لوزه ها آغاز می گردد. لوزه ها در این بیماری از مهمترین جایگاه های اولیه تکثیر ویروس بشمار می روند . به دلیل مقاوم بودن ویروس در گستره PH 5/2 تا 12 از معده و صفرا عبور کرده و وارد بخش های پائینی روده می گردد ، در این بخش ویروس یاخته های بافت پوششی روده و عقده های لنفی روده بند را مورد تهاجم قرار داده و روند تکثیر را آغاز می نماید ولی ضایعات مشخصی راایجاد نمی کند . با تکثیر اولیه ویروس دریاخته های بافت های پوششی و لنفاوی و رهایش از این یاخته ها تعداد بیشماری ویروس جدید وارد گردش خون عمومی شده و عفونت ویروسی خونی (ویرمی) اولیه پدیدار می گردد . رخداد اخیر خود به تزاید بیشتر ویروس در سامانه مشبک درون پوش عروقی می انجامد . این عفونت منتشره خونی به انتشار ویروس در ارگانهای مختلفی چون طناب نخاعی ، مغز ، پرده های مغزی ، قلب ، کبد و پوست منتهی می شود . شروع عفونت خونی ویروس (ویرمی) همزمان با بروز تب و ظهور تاول های شاخص بیماری بوده و در این مرحله ویروس را می توان در ترشحات بینی ، مایعات مری –حلقی و مدفوع یافت . بیشترین میزان ویروس در نمونه های آزمایشی را طی هفته اول عفونت می توان تعین نمود و در طی هفته دوم این میزان به کمترین حد خود می رسد.
ورود ویروس در یاخته های پوششی و شروع روند تکثیر با تغییرات استحاله ای در این یاخته ها همراه است که به بروز تغییراتی آشکاری در بافت پوششی مطبق پوست نواحی چون نوار تاجی سم ، متاتارس و متاکارپ ختم می شود. ایجاد نکروزهای انعقادی در لایه مالپیگی منجر به پیدایش تاول و پوست اندازی شده و متعاقباً رشد کاذب بافت پوششی ترمیمی[8] بصورت هیپرپلازی پدیدار می گردد . بدین ترتیب در 10 درصد از موارد ابتلای نیز ضایعات مشابهی در پوزه ، لب ها ، زبان و بر روی لوزتین ایجاد می شود. ضایعات تاولی ابتدا بر روی نوارتاجی سم و سپس بر روی انگشتچه(بند انگشت اولیه)[9] ، زبان ، نوک بینی ، لب ها ، پیاز پاشنه و سرپستانک ها ظاهر می شوند . یک التهاب مغزی و پرده مغزی خفیف غیر چرکی در خوک های مبتلا قابل مشاهده است. پیاز های بویایی به شدت و در غالب موارد درگیر هستند . شدید ترین ضایعات مغزی را 3 تا 4 روز پس از شروع عفونت می توان یافت که این رخداد خصوصاً در هنگام ورود ویروس از طریق بینی مشهود تر می باشد . همچنین در سامانه عصبی التهاب میلینی [10]، التهاب عقده های عصبی[11] و ظهور اجسام گنجیدگی در آمفی سیت ها[12]( یاخته های عصبی محیط بر یاخته های عصبی عقده) را می توان دید. تغییرات ریز بینی را نیز می توان در نوار تاجی سم ، بینی ، زبان و قلب یافت .گزارش هایی در خصوص اثرات آسیبی ویروس بر عضله قلبی[13] نیز وجود دارد.
اینترفرون ها ، پادتن های مختص ویروس از نوع IgA،IgM و IgG نقش مهمی را درتدوین ایمنی میزبانی برعهده دارند . مدت اندکی پس از بروز عفونت در مجرای گوارشی و تنفسی میزان اینترفرون و متعاقباً پادتن مختص ویروس از نوع IgA در بزاق و ترشحات روده ای و تنفسی ظاهر می گردد . اینترفرون ها موجب مهار روند تکثیر داخل یاخته ای ویروس شده و IgA با ویروس های خارج یاخته ای درهم می آمیزد(مجموعه های پادتنی- ویروسی) . تشکیل این مجموعه های پادتنی – ویروسی توسط IgA نه تنها موجب مهار انتشار ویروس در یاخته های پوششی حساس می شود بلکه انتشار دهانی – مدفوعی ویروس های عفونت زا را نیزکاهش می دهد . اولین پادتن های سرمی ظاهر شده در پاسخ به عفونت های پیکورنا ویروسی از نوع IgM بوده که در طی 2 هفته با IgG جایگزین می شود . پاسخ پادتنی از نوع IgG در طی هفته 2 تا 3 عفونت به بیشنه میزان خود می رسد و تا چند هفته در یک سطح کفه باقی مانده و سپس کاهش می یابد . هردو نوع پادتن (IgM,IgG) قادرند که با ویروس های مهاجم مجموعه های پادتنی ویروسی بوجود آورده و از انتشار ویروس در گردش خونی ممانعت نمایند . خود این مجموعه های پادتنی ویروسی نیز توسط یاخته های بیگانه خوار بلع شده ، یا هضم گردیده و یا دفع می شوند .
نشانه های بالینی:
دوره نهفته بیماری بسته به راه ورود ویروس متفاوت است در صورت بلع غذایی ویروس نشانه های بالینی 2تا3روز بعد و در صورت تماس با خوک های آلوده 2تا7 روز بعد ظاهر می شود .
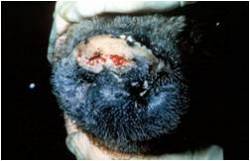
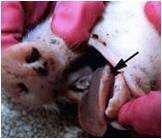
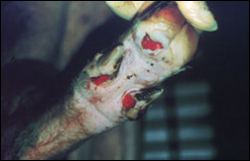
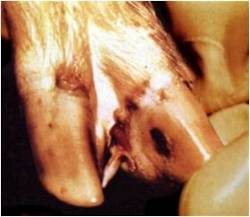
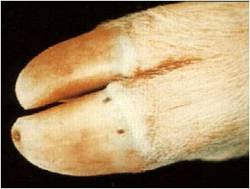
بسته به حدت نژاد ویروسی بیماری ممکن است به شکل های تحت بالینی ، خفیف یا شدید تظاهر نماید . نشانه های بالینی بسیار شبیه به بیماری تب برفکی بوده و شامل تب ، ترواش بزاق و لنگش می باشد. تاول ها و تخریش های بر روی پوزه ، غدد پستانی ، نوار تاجی سم و فضاهای بین انگشتی قابل مشاهده است . ندرتاً در حفره دهانی تاول دیده می شود . عموماً نشانه های شدید بیماری را تنها درخوکهای نگهداری شده بر روی بستر های بتونی مرطوب می توان دید . حیوانات جوان تر با شدت بیشتری مبتلا می شوند . نشانه های عصبی بدلیل التهاب مغزی ندرتاً بروز نموده که شامل لرزش ، قدم زدن غیر یکنواخت ، داءالرقص (تشنج) پاها . دام مبتلا در طی 2 تا 3 هفته با آسیب های اندک پایداری بهبود می یابد .
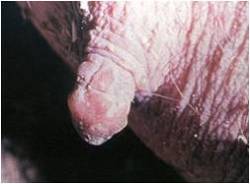
|
نشانه های بالینی |
|
تشخیص آزمایشگاهی:
برای یافت وتعین ویروس می توان از آزمون های جاذب ایمنی متصل به آنزیم (ELISA) ، ثبوت مکمل مستقیم و جداسازی ویروس در کشت یاخته های مشتق از خوک استفاده نمود . در بررسی های سرم شناسی آزمونهای خنثی سازی و ELISA کاربرد تشخیصی دارند .
|
تعین هویت ویروس | ||||
| ||||
|
آزمون های سرم شناسی | ||||
| ||||
پیش از اخذ و ارسال هر نمونه ای از خوک های مشکوک به این بیماری ، بایستی سازمان های متولی امر را مطلع نمود. به منظور مقابله با انتشار ناخواسته بیماری بایستی نمونه ها در تحت مراقبت های ویژه و حفاظتی به آزمایشگاه مرجع ارسال گردند. نمونه های مورد نیاز عبارتند از مایع تاولی ، بافت پوششی تاول ها ، مایع حلقی مری، خون تام غیرانعقادی از دام مبتلای به تب و نمونه های سرمی و خونی از حیوانات آلوده و غیر آلوده .
|
اگر چه ویروس بسیار پایدار می باشد، نمونه ها را بایستی در تحت شرایطی مشابه با تب برفکی ارسال نمود (PH 2/7-4/7). |
|
برای جداسازی ویروس |
|
|
برای آزمون های سرم شناسی |
|
یافته های کالبد گشایی:
مشاهدات کالبد گشایی در خوک های مبتلای درصورتی که را ورود ویروس به روش خوراکی بوده با ظهور تاول های برروی سطح پشتی زبان یک روز پس از آلودگی آغاز می شود . ضایعات یاد شده سفید،کدر و کوچک هستند (باقطری در حدود 2 میلی متر) . معمولاً این ضایعات بصورت گروهی و در مجاورت یا داخل بخش مرکزی زبان ظاهر می گردند . تا روز سوم آلودگی اغلب تاول ها پاره شده و برخی با ترشحات فیبرینی خونی پوشیده می شوند . گروهی دیگر عفونت ثانویه یافته و بصورت پرخون و نکروزه در می آیند و برخی نیز توسط غشای زرد رنگ چرکی ، ظریف و مرطوبی که به راحتی از بافت های زیرین جدا نمی گردد پوشیده شده اند. تا روز دوم آلودگی بر روی سطح داخلی لب ها زخم هایی پدیدار می گردد . این ضایعات خفیف بوده ، نواحی محدودی را متاثر کرده و معمولاً در طی 3 روز بهبود می یابند .
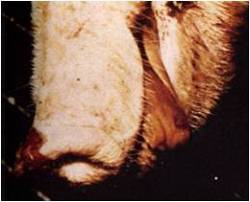
در تحت شرایطی که تماس مستقیم با حیوانات مبتلا منشاء آلودگی است معمولاً اولین یافته پیدایش ضایعاتی در پوزه خوک می باشد که 2روز پس از آلودگی قابل مشاهده است . این ضایعات غالباً محدود به بخش مرکزی لبه(شیار) مرزی پوزه هستند . بعدها ضایعات دیگری نیز در پشت لبه مرزی ظاهر می شوند ولی هرگز این ضایعات را در سطح پهن و حساس پوزه نمی توان یافت . این تاول ها پیوسته بزرگ شده تا اینکه پاره می شوند و بدون تشکیل دلمه های زرد خشک می گردند .
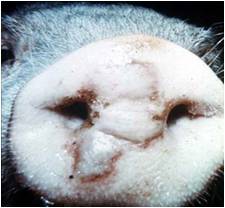
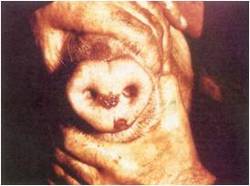
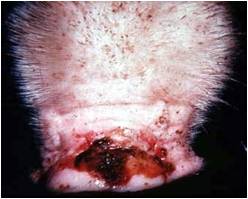
اولین ضایعات تاولی در نوار تاجی سم سه روز پس از آلودگی ظاهر شده و در روز چهارم پاره می شوند . این ضایعات عموماً بزرگ شده ، فضاهای بین انگشتی را دربر گرفته و غالباً به صورت یک التهاب پوستی نکروزه شونده به همراه بروز اختلالات حرکتی پیشرفت می کنند . هیچ نوع ضایعه ای در دیگر بخشهای پوست یا جایگاه های مخاطی پوستی یا اندام های داخلی ایجاد نمی گردد .
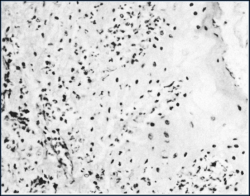
به لحاظ ریزبینی یک روز پس از آلودگی ضایعات نکروز شونده حادی در بافت پوششی زبان پدیدار می شود . در طی 24 ساعت بعدی این کانون های نکروزه کوچک بزرگ شده و تمامی لایه های بافت پوششی را دربر می گیرند . برخی از این کانون های نکروزه محتملاً به تاول های داخل بافت پوششی تبدیل می شوند . ریز آبسه های در این کانون های نکروزه تشکیل شده که با حضور نوتروفیلها به همراه مقادیر کمی از یاخته های تک هسته ای مشخص می شوند .{ تصویر زیر ریز آبسه ای در بافت پوششی زبان است که یک روز پس از آلودگی تظاهر نموده .ادم داخل یاخته ای و نکروز (مرگ یاخته ای) نیز مشهود می باشد }.
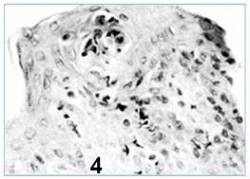
همچنین ضایعاتی نیز در اپیدرم پوزه پدیدار می گردند که بصورت کانون های نکروزه کوچک بوده و معمولاً در روز دوم پس از آلودگی ظاهر می شوند ، این ضایعات تا روز سوم به تاول های داخل اپیدرمی چندبخشی[14] تبدیل می گردند {تصویر 4 زیر کانون نکروزه اپیتلیالی از لایه خار دار پوزه دو روز پس از آلودگی است}.
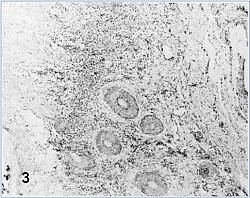
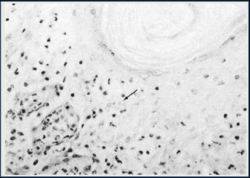
لایه اپیدرمی درگیر بطور بارز افزایش بافتی داشته (هیپر پلاستیک) و دارای نواحی کانونی از ادم داخل و بین یاخته ای است . کانون های نکروزه کوچک متعددی در طبقه خاردار[15] مشهود می باشد . تاول ها نیز غالباً در این لایه مشاهده می شوند . برخی از کانون های نکروزه در لایه دانه دار[16] و یا ناحیه زیر شاخی[17] نیز دیده می شوند. کانون های فوق معمولاً در این مرحله فاقد یاخته های التهابی هستند ، ولی به هر حال یک پاسخ التهابی خفیف در لایه درمی سطحی مجاور وجود دارد. در روز سوم پس از آلودگی همچنانکه ضایعات فوق گسترش می یابند نکروز ، ادم و تخریب یاخته های اپیدرمی حاصل شده و منجر به استحاله شبکه ای [18] توام با شکل گیری تاول های اپیدرمی چند بخشی می گردد (تصویر 3 بالا). ساختار های فوق توسط تاول های همجوارمتعددی که در آنها باقی مانده های نکروزه، تعداد کمی یاخته های آکانتولیتیک [19] ، یاخته های التهابی شامل لنفوسیت ها ، نوتروفیل ها و اندکی ائوزینوفیل حضور دارند مشخص می شوند . همین نوع یاخته های التهابی در پاسخ های التهابی درمی حضور دارند . گنجیدگی های ائوزینوفیلی کوچکی در سیتوپلاسم شماری اندکی از یاخته های سنگ فرشی مجاور کانون نکروزه دیده می شوند که در هاله ای محصورهستند (تصویر زیر-فلش) .
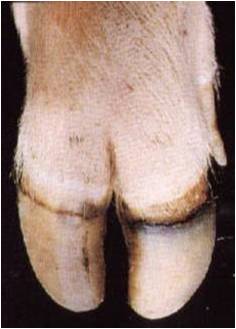
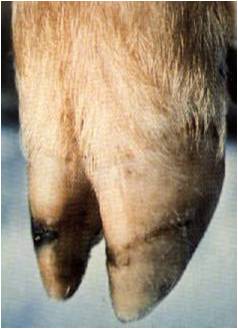
ضایعات بیماری در پوست نوارتاجی سم تقریباً مشابه با همان هایی است که در پوزه دیده می شوند ، بجز اینکه این ضایعات ابتدا عاً در روز سوم پس از آلودگی ظاهر می شوند . پاسخ های التهابی که در پوست نوار تاجی سم بروز می کنند بسیار شدید تر از پاسخ های بوجود آمده در پوزه است .
ضایعاتی مربوط به بیماری درغالب نمونه های مربوط به بافت های عصبی بجز مخچه قابل مشاهده است ، اگر چه این ضایعات از نظر تعداد و شدت در بافت های مختلف سامانه عصبی مرکزی همان حیوان متفاوت می باشند . ساقه مغزی و بخشی ازمغز پیشین [20] (پیاز بویایی[21]) بیشترین و شدید ترین ضایعات را دارند ، اگر چه ضایعات در نیم کره های مغزی و طناب نخاعی نیز قابل رد یابی هستند . اصلی ترین ضایعه در سامانه عصبی مشخص کننده التهاب مغزی نخاعی و پرده های مغزی غیر چرکی[22] است(تصویر زیر).
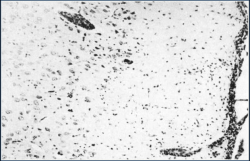
نفوذ خفیفی از یاخته های تک هسته ای همچون پوشینه پیرامون عروقی[23] و عقده های میکروگلیال نشانگر تغییرات اولیه در 24 ساعت پس از آلودگی است . ضایعات فوق در روز سوم آلودگی به شدیدترین میزان خود می رسند . یاخته های تک هسته ای در مقادیر زیادی پیرامون فضاهای عروقی تجمع می کنند . یاخته های نفوذی عمدتاً لنفوسیت های بزرگ و کوچک و تا اندازه ای ائوزینوفیل ها هستند . ضایعات فوق خصوصاً در پایک مغزی [24] ، تالاموس و پل مغزی[25] آشکار می باشند .بسیاری از یاخته های عصبی(نورون ها) تحت استحاله یا نکروز بوده و همراه با آن افزایش یاخته های نورگلیای پیرامون نورونی [26] و تخریب بیگانه خواری یاخته های عصبی [27] وجود دارد . یاخته های گلیال در بافت پارانشیمی نواحی بزرگ جمع شده و همراه آن ممکن است باقی مانده های نکروزی نیز بطور اتفاقی حضور داشته باشند . همچنین نفوذ متوسط یاخته های تک هسته ای غالباً در پرده های مغزی قابل مشاهده است .
یک روز پس از آلودگی کانون های نکروزه کوچک بطور پراکنده در عضله قلبی قابل رد یابی می باشند . یاخته های عضلانی درگیر قلب حاوی سیتوپلاسم غیر شفاف و هسته فشرده[28] یا قطعه ای شده هستند . تعداد اندکی از یاخته های التهابی –عمدتاً لنفوسیت – در بافت های بینابینی نفوذ می کنند .
تشخیص تفریقی:
بیماری تاولی خوک بایستی در هنگام که تاول و تخریش هایی بر روی دهان و یا پا های خوک ظاهر می شوند ، مورد توجه قرار گیرد . در همه گیری های بیماری تاولی خوک تنها گونه تحت تاثیر خوک ها هستند ، ضایعات ایجاد شده خفیف بوده و هیچ گونه تلفاتی دیده نمی شود . بیماریهایی که در تشخیص تفریقی با بیماری تاولی خوک مورد توجه هستند عبارتند از: تب برفکی ، تورم تاولی دهان [29]، جوش تاولی خوک [30]و سوختگی های شیمیایی و حرارتی . نظر به اینکه بیماری های فوق با تکیه بر نشانه های بالینی قابل تمیز نیستند لذا آنها را بایستی با آزمون های تشخیصی نفی کرد .
جنبه های بهداشت عمومی:
عفونت انسانی در مواردی از کارکنان آزمایشگاهی گزارش گردیده که تغییر سرمی و بیماری بالینی خفیفی بدون هیچ موردی از التهاب پرده های مغزی مشاهده شده . لذا به هنگام کار با نمونه های مربوط به این بیماری بایستی موارد حفاظتی رعایت گردد .
درمان بیماری:
درمان اختصاصی و موثری بر علیه بیماری وجود ندارد .
کنترل و پیشگیری:
اساساً واکسن موثری برای بیماری وجود ندارد واقدامات پیشگیرانه مشابه موارد اعمالی در بیماری تب برفکی است. کنترل حمل ونقل خوک ها از مناطق آلوده ، امحاء بهداشتی زباله های هواپیمای و کشتی های حمل و نقل دامی ، و پخت کامل زباله ها مصرفی در دامداری از اقدامات اساسی در امر پیشگیری می باشد. حیوانات آلوده بایستی در محل محدود شده ای قرنطینه شوند .
اقدامات ریشه کنی برای بیماری شامل اعمال برنامه های قرنطینه ای درمزارع ، مناطق آلوده و کانون های آلوده بیماری ؛ تخلیه و امحاء خوک های آلوده و در معرض تماس ؛ و پاکسازی و ضدعفونی کردن تجهیزات و جایگاه نگهداری دام ، می باشد . در مورد اقدامات ضد عفونی بایستی توجه داشت که حضور مواد آلی می تواند نقش ترکیبات ضد عفونی کننده را مخدوش نماید که به این منظور توصیه می گردد پس از پاکسازی از هیدرواکسید سدیم 1٪ بصورت ترکیب با ترکیبات پاک کننده استفاده نمود . مواد اکسید کننده و یدوفور به همراه پاک کننده ها در عدم حضور مواد آلی برای ضدعفونی کردن شخصی مناسب می باشند .
[1] Swine vesicular disease virus
[2] protomers
[3] internal ribosome entry site
[4] polyprotein
[5] coxsackie- and adenovirus receptor
[6] decay-accelerating factor
[7] reticuloendothelial
[8] Regenerative pseudoepitheliomatous
[9] dewclaw
[10] Myelitis
[11] Gangelioneuritis
[12] Amphicytes
[13] myocardiophaty
[14] Multilocular
[15] Stratum spinosum
[16] Granular layer
[17] Subcorneal area
[18] Reticular degeneration
[19] Acantholtic cells
[20] Telencephalon
[21] Olfactory bulb
[22] Nonsuppurative meningoencephalomyelitis
[23] Perivascular cuff
[24] Peduncle
[25] Pons
[26] Satellitosis
[27] Neuronophagia
[28] Pyknotic
[29] vesicular stomatitis
[30] vesicular exanthema of swine
