بيماري هاي اخطار كردني گروه A
طاعون نشخوار کنندگان کوچك
A050
[Peste des petits ruminants]
[Pest of Small Ruminants]
[stomatitis-pneumoenteritis complex]
[syndrome pseudorinderpest of small ruminants]
kata [Pidgin English for catarrh]
Pseudo-rinderpest
تعریف:
بیماری طاعون نشخوارکنندگان کوچک (PPR) یک ناخوشی واگیر دار حاد یا تحت حاد با عامل ویروسی در بز و گوسفند بوده که باتب ، التهاب دهانی- تخریشی ،التهاب ملتحمه ای ، التهاب ریوی(پنومونی) و مرگ مشخص می گردد. این بیماری به لحاظ ریخت آسیب شناختی و بالینی شباهت نزدیکی با بیماری طاعون گاوی دارد . در میان دامهای حساس یاد شده بز ها بیشتر از گوسفندان تحت تاثیر بیماری قرار می گیرند . کاتا برای اولین بار این بیماری را التهاب دهانی و ریوی بزهای قد کوتاه نیجریه ای نامید . در سال 1942 عبارت طاعون نشخوارکنندگان کوچکPPR که واژه ای فرانسوی است و بطور مشابه در گوسفندان دیده می شود برای این بیماری بکار رفت. بعد ها مشخص شد که هر دو بیماری بطور تنگاتنگ با یکدیگر مرتبط می باشند . بسیاری از مولفین وجه تسمیه طاعون گوسفندی [1] یا بزی [2] را برای این بیماری بکار بسته اند ولی سازمان های رسمی چون FAO و OIE همان واژه فرانسوی را بکار می برند .
تاریخچه بیماری:
تعین هویت طاعون نشخوار کنندگان کوچک در آفریقای غربی بعنوان یک عامل بیماری زای مستقل از طاعون گاوی که موجب درگیری نشخوار کنندگان کوچک می شود شکاف ممیزه ای در تاریخ بیماری طاعون حیوانات به حساب می آید. این بیماری برای اولین بار (1942) توسط گارگادنیک و لالن که در ساحل ایوری کار می کردند شناخته شد. این محققین بیماری را در بزها و گوسفندان یافته بودند که مشابه بیماری طاعون گاوی بود ولی گاوهای در معرض تماس مبتلای نمی شدند . مشاهده فوق آنها را به این نتیجه رسانید که بیماری شبیه طاعون گاوی است ولی متمایز از آن می باشد، از این رو آن را طاعون نشخوار کنندگان کوچک نامیدند . در سال 1956 مورنیت و کولابوراتور نشان دادند که ویروس های طاعون گاوی و طاعون نشخوار کنندگان کوچک به لحاظ پادگنی ارتباطی تنگاتنگ دارند . در سال 1962 عامل این بیماری توسط گیلبرت و مونییر در کشت یاخته های گوسفندی تعین شده و بعد ها توسط بوردین و لارنت (1967) با ریزبین الکترونی مشاهده گردیدند. در سال 1979 گیبز و کولابوراتور براساس شاخص های مجزای این ویروس ، آن را در کنار طاعون گاوی ، سرخک و دیستمپر بعنوان چهارمین عضو از موربیلی ویروس ها طبقه بندی نمودند . زمانی تصور می شد که بیماری محدود به بخش های غرب آفریقا است ، ولی بعداً مشخص شد که بیماری از اکوادور تا کویر صحرا گسترده است و همچنین در آسیا و خاور میانه نیز حضور دارد . اگر چه افزایش شناخت در مورد بیماری یکی از دلایل انبساط گستره جغرافیائی بیماری است ولی این احتمال نیز مطرح است که ویروس در حال انتشارمی باشد.
سبب شناسی:
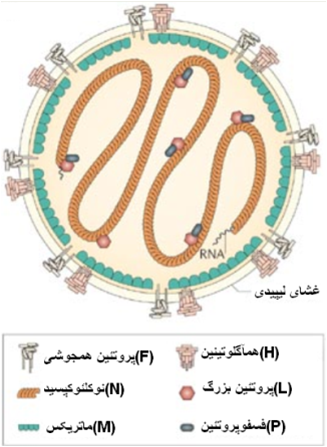
عامل بیماری ویروسی کروی شکل پوشش دار با ژنوم تک رشته ای از نوع RNA و قطبیت منفی از راسته منونگاویرال خانواده پارامیکس ویریده و جنس موربیلی ویروس و گونه ویروس طاعون نشخوارکنندگان کوچک PPRV می باشد . تاکنون چهار نوع از اعقاب ژنتیکی[3] (4-1) برای این ویروس مشخص شده است . این اعقاب ویروسی از بخش های مختلف جهان گزارش شده اند ؛ اعقاب نوع یک و دو در بخش هائی از آفریقا حضور دارند و نوع سوم در هندوستان دیده شده نوع چهارم از اعقاب این ویروس در خاور میانه و برخی از مناطق هندوستان قبل مشاهده شده . این ویروس در ارتباطی نزدیک به ویروس طاعون گاوی بوده بطوری که پادتن های PPRV و ویروس طاعون گاوی ایمنیت متقاطع بوجود می آورند و مایه کوبی با واکسن طاعون گاوی قادر است حفاظتی در برابر PPR پدید آورد . از این رو وجود چنین واکنش متقاطعی در آزمون های تشخیصی ایجاد تداخل می نماید . ویروس در برابر واکنش های فیزیکی و شیمیائی مقاوم است . این ویروس ممکن است دمای 60 درجه سانتی گراد را تا 60 دقیقه تحمل نماید. ویروس در PH مابین 4 و 10 پایدار است . ویروس نسبت به ترکیبات شیمیائی چون الکل ، اتر و مواد پاک کننده حساس است ، همچنین ویروس نسبت به اغلب ترکیبات ضدعفونی کننده ای چون فنل و هیدرواکسید سدیم 2 درصد حساس می باشد . ویروس قادر است در بافت های سرد شده و یخ زده بمدت طولانی فعال بماند .
همه گیر شناسی :
درمیان دام های اهلی بیماری اساساً در گوسفند وبز دیده می شود . به نظر می رسد که ویروس بیماری در یک همه گیری پدیدار شده در اتیوپی (1996-1995) که شتر ها را درگیر نمود ایفای نقش داشته است . گاو معمولاً بصورت بی نشان آلوده شده و بنظر نمی رسد که بیماری را به حیوانات دیگر منتقل نماید . این عفونت تحت بالینی در گاو منجر به تغییر و تبادلات سرمی گردیده بطوری که گاو را در برابر ویروس طاعون گاوی محفوظ می دارد . خوک هائی که بطور تجربی آلوده شده اند هیچ گونه نشانه بالینی را از خود بروز نمی دهند . خوک و گاو بدلیل آنکه ظاهراً از انتقال بیماری به دیگر حیوانات ناتوان هستند در همه گیری های این بیماری ایفای نقش نمی کنند . بیماری طاعون نشخوارکنندگان کوچک می تواند در برخی از حیوانات سم دار وحشی بوجود آید اما اطلاعات محدودی در مورد گونه های حساس و وقوع آن دردست می باشد . این بیماری در دو همه گیری ، یکی در غزال های دورکاز (Gazella dorcas) وغزال های تامسون (Gazella thomsoni) در عربستان صعودی(2002) و دیگری در بوفالوها در هندوستان (1995) مشاهده گردیده. همچنین بیماری بصورت یک همه گیری در غرال ها و گوزن های عربستان صعودی (1980) گزارش شده . گوزن دم سفید آمریکائی(Odocoileus virginianus) را بطور تجربی می توان آلوده نمود . علاوه بر این موارد بیماری طاعون نشخوارکنندگان کوچک در بزگوهی(مارال) حبشه ای گوسفندلاریستان و بزکوهی بزرگ آفریقائی(gemsbok) گزارش گردیده .
بیماری در زمانی که برای اولین بار بر جمعت بومی یک منطقه تحمیل شد به شدت مسری است . نسبت مبتلایان در یک گله حساس Morbidity rate)) تا 90 درصد و میزان تلفات Mortality rate)) به 50 تا 80 درصد می رسد . در مناطقی که بیماری بومی شده (مشابه طاعون گاوی) میزان شیوع بیماری همواره اندک است و معمولاً در این مناطق حیوانات مابین 3 ماه تا 2 سال سن بشدت درگیر می شوند ؛ و بیماری درحیوانات جوان که در دوره شیر خواری بوده و دامهای مسن ترقابل اغماز است . زمانی که جمعیتی حساس شکل گرفت (ورود دام های جدید یا مخلوط کردن دامها) همه گیری دوره ای پدیدار می گردد . در یک چنین همه گیری هائی در گله های گوسفندی و بزی میزان تلفات تقریباً تا 100 درصد هم می رسد . برخی از همه گیری ها همراه با تغییرات آب و هوائی همچون شروع یک فصل بارانی یا سرما ، یک دوره خشکی پدیدار می شوند .
طاعون نشخوارکنندگام کوچک یک بیماری بشدت واگیر دار نیست و انتشار بیماری بواسطه تماس مستقیم و نزدیک مابین حیوانات محقق می شود ، که در این انتقال روش استنشاقی مهم ترین شیوه می باشد ولی بدلیل شکننده بودن ویروس در محیط خارج انتشارهمراه با ذرات معلق برای مسافت های طولانی متصور نیست، در یک بررسی معلوم گردید که ویروس درشرایط آب و هوایی سرد و تاریک تنها تا 10 متر قابلیت انتشار دارد. ترشحات چشمی ، دهانی ، بینی و دفعی حاوی مقادیر وافری ویروس است ، قطرات عفونی ریزی که از این ترشحات آلوده در هوا پراکنده می شود – خصوصاً در موقعی که حیوان بیماری سرفه و عطسه می کند – راه مناسبی برای انتشار بیماری است . اگر چه تماس نزدیک از مهمترین راه های انتقال بیماری است ولی این تصور نیز غیر محتمل نیست که اشیاء و مواد آلوده بتوانند آخور غذا و آب و همچنین بستر جایگاه را آلوده ساخته و آنها را به منابع دیگراز عفونت تبدیل نمایند . اشیای بی جانی چون آب ، آخور غذا و بستر احتمالاً ویروس بیماری را برای یک دوره زمانی کوتاه منتشر می کنند . اطلاعات اندکی درخصوص قابلیت بقای ویروس PPR در محیط وجود داد ولی این ویروس بسیار شبیه به ویروس طاعون گاوی بوده بطوری که در اثر نور ماوراءبنفش و خشک شدن در طی 4 روز غیر فعال شده و بطور معمول برای دوره کوتاهی در لاشه دامی فعال می ماند .در دمای بالای 70 درجه سانتی گراد و همچنین در PH کمتر از 6/5 یا بیشتر از 6/9 ویروس این بیماری غیرفعال می گردد. ویروس PPR ممکن است همانند ویروس طاعون گاوی برای مدتی در گوشت یخچالی و چندین ماه در گوشت یخ زده فعال بماند ؛ ولی در هر حال انتقال ویروس از این طریق به گوسفند و بزغیر محتمل است .
دامهای مبتلا در دراز مدت بعنوان حامل بیماری عمل نمی کنند و عموماً همانند بیماری طاعون گاوی حاملی برای آن وجود ندارد.حیوانات آلوده ممکن است ویروس را در طی دوره نهفته بیماری منتشر نمایند . در یک برسی بر مبنای ارزیابی حضور پادگن های ویروسی در مدفوع دیده شد که بزهای مبتلا ی بهبود یافته تنها تا 11 و 12 هفته بعد به لحاظ پادگن ویروسی مثبت بوده اند . انتشار بیماری از منطقه ای به منطقه دیگر از طریق انتقال دام بیمار محقق می گردد . بدلیل اینکه ویروس در محیط خارج غیرفعال می شود انتشار غیر مستقیم بیماری عموماً محدود می باشد . حتی در گله های مبتلا در مناطق عاری از بیماری که تماس نزدیکی مابین دامها وجود دارد اتنشار بیماری سریع نبوده و موارد جدید بیماری در طی یک دوره ماهانه بصورت روزانه تظاهر می نماید . انتشار بیماری بسته به فصل متنوع است بطوری که بیشترین موارد همه گیری ها در طی فصول بارانی یا سرد و خشک مشاهده می شوند. منابع آلودگی ویروس شامل ترشحات چشمی(اشک )، ترشحات بینی ، ترشحات حاصل از سرفه ، تمامی ترشحات و مواد دفعی(مدفوع و ادرار) و احتمالاً شیر حیوانات مبتلائی که در مرحله نهفته بوده یا بیمار هستند ، می باشد.
روند بیماری زائی:
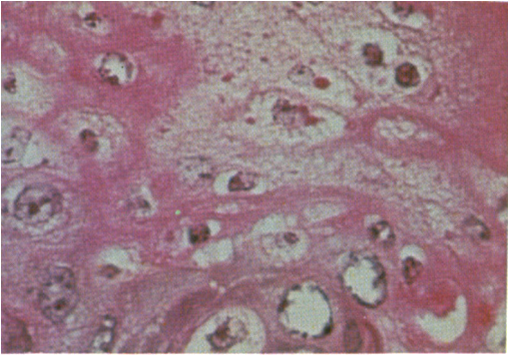
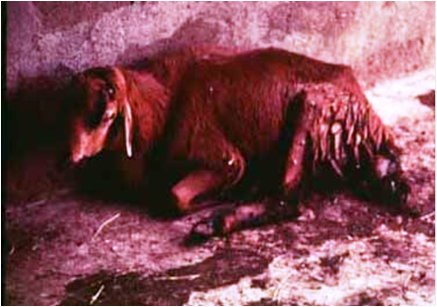
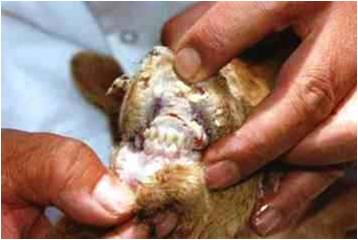
پس از ورود ویروس با ذرات معلق آلوده به سامانه تنفسی ، در ابتدا به غدد لنفاوی ناحیه ای شامل حلقی ، فکی و لوزه ها وارد و در آن غدد تکثیر می یابد . بدنبال این تکثیر اولیه ویروس وارد خون شده و آلایش اولیه خونی (ویرمی اولیه) را بوجود می آورد ، نتیجه این رخداد گسترش ویروس به غدد لنفاوی احشایی ، طحال ، مغز استخوان و مخاطات سامانه های تنفسی و گوارشی است . اولین واکنش بدن در برابر حضور ویروس افزایش دمای بدن است که خود در نتیجه افزایش ترشح اینترلوکین نوع اول(IL-1) از یاخته های بیگانه خواری است که درغدد لنفاوی در تحت تاثیر ویروس فعال شده اند ، این واکنش تب معمولاً از روز سوم تا پنجم پس آز آلودگی آغاز شده و به مدت 5 تا 10 روز تداوم داشته و پس از آن بتدریج فروکش می کند . نتیجه حضور ویروس در سامانه لنفاوی فعال شدن دفاع ایمنی اختصاصی و غیر اختصاصی بوده که خود آغازی برای فعالیت ایمنی هومورال و سلولی است . بررسی ها نشان می دهد که ویروس PPR موجب یک ضعف ایمنی [4]بارز می شود که با کاهش شمارش گویچه های سفید خونی ، کاهش شمارش یاخته های لنفاوی و افت پاسخ دهی اولیه پادتنی به پادگن های اختصاصی و غیر اختصاصی تظاهر می نماید . این تغییرات خصوصاً در طی مرحله حاد بیماری (4 تا10 روز پس از آلودگی) مشهود است . الگوی جذب ویروس به یاخته های لنفی و چگونگی تکثیر آن شبیه به ویروس های خانوداده پارامیکس ویریده است . نهایتاً پس از رهایش ویروس ها و انتقال آن به گردش خون ویرمی اولیه پدیدار می گردد . مطمعناً انتخاب موضع اولیه ویروس در روند بیماری زائی بدلیل حضور گیرنده های خاصی در سطح یاخته های هدف است که سبب جذب ویروس در آن ناحیه می گردد که تاکنون ناشناخته است. با انتشار ویروس از طریق گردش خون و رسیدن آن به غدد لنفاوی احشائی ، طحال ، مغز استخوان و مخاطات سامانه های گوارشی وتنفسی - که خود ناشی از حضور گیرنده های ویروسی است - روند تکثیر ثانویه ویروس آغاز می گردد . وجود پروتئین همجوشی(F) در لایه پوششی هر ویشه (ویریون) ویروسی PPR همانند دیگر ویروس های خانواده پارامیکس ویریده موجب بروز اثرات آسیبی در یاخته های آلوده می شود. این پروتئین به لحاظ زیستی فعال بوده بطوری که در روند همولیز ناشی از ویروس ، همجوشی یاخته ای و آغاز عفونت ایفای نقش می نماید . پروتئین همجوشی نوعی همولیزین است که سب متلاشی شدن گویچه های سرخ می شود، از طرفی این پروتئین با ایجاد همجوشی میان یاخته های آلودی موجب تشکیل مجموعه پیوسته ای از یاخته ها (سنسی شیا)[5] می گردد ، این پیوستگی یاخته ای تظاهری آسیب شناسی از بیماری در بافت های لنفاوی و پوششی آلوده است . همچنین لازمه آغاز عفونت که نفوذ ویروس در یاخته است با حضور این پروتئین محقق می گردد. تکثیر ثانویه ویروس پس از آلایش خونی اولیه (ویرمی اولیه) در بافت های مختلف بدن منجر به پیدایش ضایعات بیماری می شود . تهاجم ویروس به یاخته های پوششی (تنفسی، گوارشی ) منجر به بروز ضایعاتی می شود که از یک جهت بدلیل اثرات کشندگی یاخته ای ویروس است بطوری که در برسی های هیستوپاتولوژی دژنرسانس آبکی یاخته های پوششی در مخاطات دهانی مشهود است که خود آغاز روند مرگ یاخته ای است (تصویر زیر).
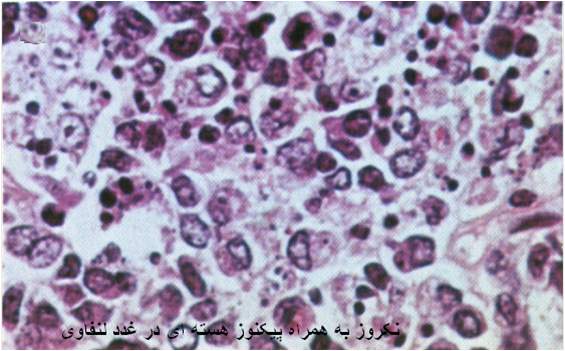
همچنین در غدد لنفاوی حضور ویروس همراه است با تخلیه یاخته های لنفاوی و افزایش تمرکز یاخته های بیگانه خوار در مراکز زایگر و سینوس های غدد لنفاوی ، در یک چنین غددی یاخته های لنفی پیکنوزه [6]بوده و دچار کاریورکسی [7] هستند . نتیجه چنین رخدادهای یاخته ای که منتهی به مرگ یاخته های لنفاوی می شود با بروز نکروز،تخلیه یاخته های لنفاوی و خونریزی هائی در غدد لنفاوی همراه است (تصویر زیر).
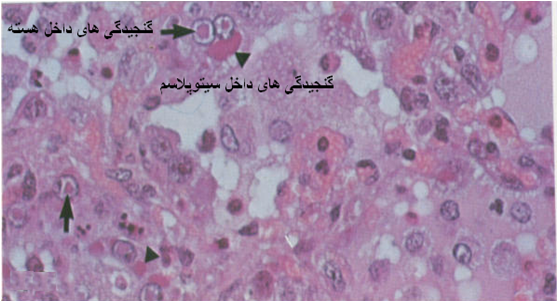
در طحال که متورم است نشانه های خونریزی گسترده تر بوده و نکروز به همراه جاگزینی هموسیدرین است . درریه ها با تهاجم ویروس تظاهرات آسیب شناختی بصورت یک پنومونی بینابینی منتشره با بروز سختی در قطعچه های قدامی شکمی خود را نشان می دهد ، این التهاب ریوی در واقع ناشی از آلوده شدن یاخته های پوششی حبابچه های ریوی [8] به ویروس بوده که در برسی های ریزبینی آسیب شناسی با حضور گنجیدگی های ائوزینوفیلی داخل هسته ای و سیتوپلاسمی (در یاخته های بیگانه خوار حبابچه ای و یاخته های سنسیشیال) و وجود یاخته های درشت پیکر [9] حبابچه ای قابل مشاهده است .
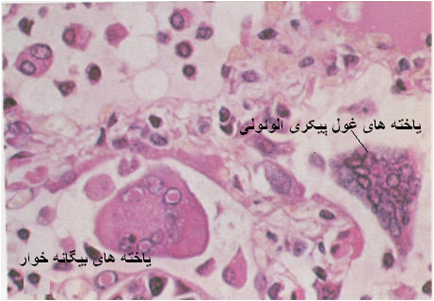
ویروس بواسطه پروتئین همجوشی موجب به هم پیوستن یاخته های پوششی حبابچه ای شده که نهاتاً با ایجاد این سنسیشیوم یاخته های درشت پیکر حاصل می آیند . از طرفی نیز سامانه ایمنی بدن که اکنون ویروس را بواسطه دفاع ایمنی اختصاصی شناسائی کرده موجب بروز روند های التهابی می شود که نتیجه آن پنومونی بینابینی منتشره است . تغییرات یاد شده در ریه غالباً پیچیده تر شده و بصورت یک پنومونی سروزی فیبرینی خود را نشان می دهد . در سامانه گوارشی مخاطات عمدتاً مورد تهاجم ویروس قرار می گیرند و بررسی های آسیب شناسی بافتی در ارگان های اصلی این سامانه حاکی ازنکروز و دژنر سانس مخاطات لبی ،پرخونی شدید مخاطی و زیر مخاطی ، نکروز و دژنرسانس پوششی روده ای و تخلیه یاخته های لنفی از پلاک های پایر همراه با وجود سنسیشیوم است ، در روده کوچک پرز ها روده ای تحلیل رفته ، خمل های روده ای مملو از قالب های متراکم یاخته ای [10] هستند ، یاخته های لنفی از پلاک های پایر تخلیه شده اند و گنجیدگی های ائوزینوفیلی داخل هسته ای در یاخته های پوششی حضور دارند ، تمامی این رخداد های آسیبی ناشی از اثر کشندگی ویروس است که در روند تکثیر موجب مرگ یاخته های لنفی و پوششی آلوده می گردد . با ازمحلال یاخته های پوششی در مخاطات گوارشی (دهانی و روده ای) تخریش های زخمی شونده و خونریزی های زیر جلدی حاصل می آید. بروز این تخریش های مخاطی در روده ها به ایجاد اسهال منتهی می شود.
نشانه های بالینی :
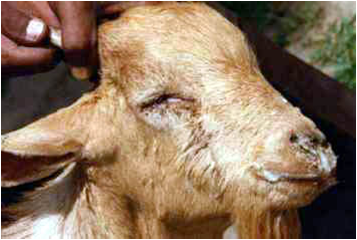
دوره نهفته بیمار متغیر بوده که از 2 تا 10 روز می باشد ، در غالب موارد نشانه های بالینی در طی 2 تا 6 روز خود را نشان می دهند. سیر تغییرات بالینی همانند طاعون گاوی است ولی سریع تر رخ می دهد . معمولاً شدت بیماری بسته به گونه دام، همچنین میزان ایمنیت دام به بیماری و نژاد دام متفاوت می باشد . زمانی که بیماری طاعون نشخوارکنندگان کوچک برای اولین بار در یک منطقه شیوع می یابد این احتمال هست که دام های حساس تنها با داشتن تب بالا و افسردگی شدید بدون هیچ گونه نشانه مشخص بالینی تلف شوند . به هر حال نمایان ترین چهره بیماری در یک گله ،انتشار سریع نشانگان بیماری در جمعیت گوسفندی و یا بزی است که با آغاز ناگهانی افسردگی ،شروع ترشحات چشمی ،بینی و دهانی ، تنفس غیر عادی و سرفه ، اسهال و مرگ مشخص می گردد، ایجاد تخریش های مخاطی همراه است با ترشحات مخاطی فراوان و اسهال های پرتابی . ترشحات بینی و چشمی مخاطی چرکی و دلمه ای شده بطوری که موجب انسداد منخرین می گردند و پلک های چشم را به هم می چسبانند . پنومونی نیز بر وخامت وضعیت دام می افزاید. یک چنین دامی دارای تنفس و اسهالی بد بو است .
در غالب همه گیری ها علارغم اینکه گوسفندان و بزها هردو نسبت به بیماری حساس هستند ولی در بیشتر موارد هر دو نوع دام بطور همزمان درگیر نمی شوند . در تاریخچه بیماری موارد ذیل دیده میشود: نقل و انتقالات دامی ، پرورش توام گوسفندان یا بزها با گروه های سنی متفاوت بدون تغییر در شرایط نگهداری و تغذیه ای، ورود دام های تازه خریداری شده ، تماس نزدیک گله های روستائی با گوسفندان و بز های که بدلیل عدم فروش در میادین دوآب به گله باز گشته اند ، تغییرات آب و هوائی چون شروع فصول بارندگی یا خشکی ، دوره های سرما ، تماس با دام های تجارتی یا عشایری در طی چرای مشترک . در مناطقی که بیماری بومی شده غالب دام های بیمار و تلف شده در گروه سنی 4 ماه تا 2 سال قرار دارند . مشاهدات میدانی و آزمایشگاهی حاکی از این مطلب است که بروز بیماری در گوسفند شدت کمتری درمقایسه با بز دارد. در حیوانات جوان تر (4تا8ماهه) بیماری شدت بیشتری داشته و میزان شیوع و تلفات بالا است . وضعیت تغذیه ای ، استرس حمل ونقل و آلودگی های همزمان انگلی و باکتریائی می تواند شدت نشانه های بالینی را افزایش دهد .
بیماری در سه شکل قابل مشاهده است : 1)شکل فوق حاد بیماری 2) شکل حاد بیماری 3) شکل تحت حاد ومزمن بیماری .
شکل فوق حاد را زمانی می توان دید که بیماری برای اولین بار در یک جمعیت بومی گوسفندی (عمدتاً) یا بزی (ندرتاً) شیوع یافته . نشانه های بالینی عموماً محدود به تب بالا ، افسردگی شدید و مرگ می باشد . دام های تلف شده دارای ترشحات سروزی ، کف آلود یا خونی هستند که از بینی خارج می شود . در بیشتر موارد بروز بیماری بصورت حاد یا تحت حاد است .
در شکل حاد بیماری با دوره نهفته 4 تا 5 روز ، نشانه های اولیه عبارتند از : افزایش ناگهانی دمای بدن که 5 تا 8 روز تداوم دارد ، زمین گیری درمواردی بصورت خود استماعی[11](سر دام به سمت شکم برگشته)،بی قراری ، بی اشتهائی ، افسردگی ،خشک شدن پوزه ،پ
