بيماري زبان آبي (Bluetonque)
بیماری زبان آبی؛تب نزله ای یا زکامی؛
همه گیری زکامی گوسفند
Bluetonque;catarrhal fever;
epizootic catarrh of sheep

تعریف:
بیماری زبان آبی اساساً یک بیماری غیر مسری بندپا بر[1] گوسفندی است که گاهی در گاو نیز دیده می شود. عامل بیماری اوربی ویروسی است که توسط حشرات حامل - پنج گونه از پشه های کولیکوئید - منتقل می گردد[2] . بیماری با التهاب زبان نزله ای [3] ، التهاب بینی ، التهاب روده ای و لنگش به جهت التهاب نوار تاجی سم و غشاهای حساس پا تظاهر می نماید . بسیاری از حیوانات از جمله گاو به ویروس این بیماری آلوده شده ولی نشانه های بالینی را نشان نمی دهند لذا عفونت زبان آبی و بیماری زبان آبی را بایستی بصورت دو مقوله مجزامورد بررسی قرار داد. شدت بیماری بسته به نژاد ، حساسیت انفرادی دام ،شرایط محیطی ، استرس و توانائی آسیب زائی سویه ویروسی متفاوت می باشد .
تاریخچه بیماری:
بیماری برای اولین بار بعنوان تب زکامی مالاریایی و همه گیری زکامی گوسفندی در منابع ثبت شده توسط محققین آفریقای جنوبی ذکر گردیده . عنوان بیماری زبان آبی بعداً به منظور توصیف موارد مجزای شدیدی که زبان حالت کبود پیدا می نمود بکار رفت . اگرچه کشاورزان آفریقای جنوبی به محض ورود نژاد های پشم نازک اروپائی به این منطقه از جهان بیماری را تشخیص داده بودند ولی شرح اولیه آن در اواخر قرن 19 و اوایل قرن 20 ارائه گردید . تا پیش از 1940 تصور بر این بود که بیماری محدود به آفریقا است . اولین همه گیری بخوبی ثبت شده بیماری و خارج از آفریقا به سال 1943 در میان گوسفندان قبرسی پدیدار گردید . به فوریت پس از این همه گیری بیماری در تگزاس تشخیص داده شد و یک همه گیری گسترده دامی در شبه جزیره ایبری (1956-1957) پدیدار گردید . متعاقباً بیماری در خاورمیانه ، آسیا و جنوب اروپا مورد تشخیص واقع گردید . امروزه روشن است که بیماری در نواحی استوایی و تحت استوایی جهان حضور داشته و مواردی از انتشار آن به مناطق معتدله نیزمحقق شده . به هرحال بیماری زبان آبی بطور نادر یا مطلقاً غایب در بسیاری از مناطق جهان وبا عفونت ویروسی بومی شده حضور دارد. علاوه بر این کاملاً روشن است که انتشار جهانی بیماری مناطقی را شامل می شود که تواماً حضور گونه های مجزای حشرات کولیکوئید بعنوان حامل نیز در آن محقق است .
سبب شناسی :

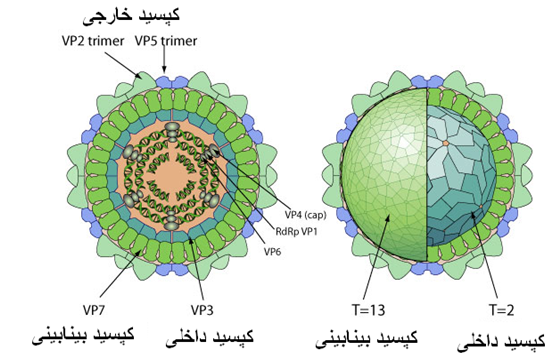
عامل بیماری ویروسی از خانواده رئوویریده [4] و جنس اوربی ویروسها[5] می باشد. ویروس بیماری زبان آبی(BTV) همانند دیگر اعضای خانواده رئوویریده ویروس فاقد پوشش ، بیست وجهی، با قطری در حدود 80 نانومتر ، غیر مناره ای[6] با ساختار مرکبی متشکل از 7 نوع پروتئین ساختاری مجزا است که در سه طبقه هم مرکز سازمان یافته اند(کپسید خارجی ، بینابینی و داخلی). کپسید خارجی که خود متشکل از دو نوع پروتئین ساختاری اصلی( به نام های VP2 و VP5) است در اتصال و نفوذ به داخل یاخته - طی مرحله آغازین عفونت - ایفای نقش می نماید. کپسید بینابینی که تقارنی بیست وجهی دارد(T=13)از پروتئین VP7 تشکیل گردیده . در مورد نفوذ ویروس به یاخته های حشرات حامل پروتئین VP7 عامل اصلی است. کپسید داخلی نیز متشکل از یک نوع پروتئین ساختاری اصلی به نام هاVP3 و سه پروتئین کوچکتر به نام های VP1,VP4,VP6 می باشد .کپسید داخلی نیز بیست وجهی است (T=2). علاوه بر این هفت نوع پروتئین ساختاری 3 نوع پروتئین غیر ساختاری نیز به نام های NS1,NS2,NS3 در یاخته های آلوده به ویروس تولید می گردد. پروتئین NS3 با جزء مربوطه آن(NS3A) در خروج ویروس های تکثیر یافته از یاخته آلوده ایفای نقش نموده و پروتئین های NS1,NS2 که به میزان زیادی در سیتوپلاسم این یاخته ها تولید شده اند در کپی برداری[7] ،گردایش[8] و ریخت زائی[9] ویروس دخیل هستند . ویروس دارای ژنوم RNA دو رشته ای منقطع در یک بخش مغزی است . ژنوم ویروسی حاوی 10 قطعه بوده که برای 12 پلی پپتید متفاوت کد گزاری شده اند. در روند بیان ژنی ژنوم این ویروس هرگز بطور کامل رو گشائی نمی شود تا به این ترتیب روند های ضد ویروسی یاخته میزبان در پاسخ به RNA دورشته ای فعال نگردند .پلی مراز ویروسی (VP1) از هر قطعه دورشته ای RNA ژنوم ویروس یک mRNA کلاهدار می سازد . این mRNA کلاهدار به سیتوپلاسم یاخته منتقل شده تا روند ترجمه را آغاز نماید . بخش مغزی ویروس توسط یک لایه پروتئینی کپسول خارجی حاوی دو پلی پپتید اصلی مختص ویروس احاطه شده است .
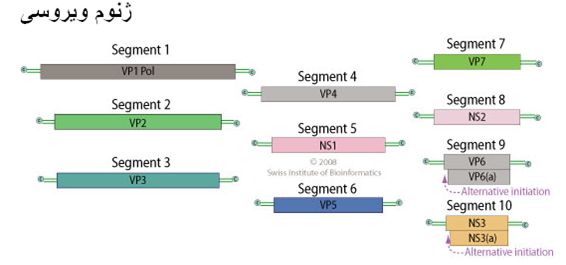
روند تکثیر ویروس در داخل سیتوپلاسم یاخته میزبان محقق می گردد که شامل مراحل زیر می باشد :
1) ویروس به گیرنده های سطحی یاخته میزبان متصل شده وبا روند اندوسیتوز بداخل حفره های داخل یا خته ای میزبان وارد می شود .
2) ویشه های ویروسی در داخل اندولیزوزوم ها بطور نسبی (ناقص)پوشش زدایی شده و بداخل سیتوپلاسم نفوذ می کنند.
3) رونوشت برداری اولیه از ژنوم ویروس توسط پلی مراز ویروسی در داخل این تحت ذرات ویروس(بخش مغزی برهنه) انجام می شود بطوری که RNA دورشته ای هرگز در معرض سیتوپلاسم قرار نمی گیرد . رونوشت های با قطبیت مثبت و طولی کامل ، ازروی هرقطعه RNA دورشته ای ژنوم تولید می شود . این رشته های مثبت بعنوان الگویی برای روند ترجمه بکار می روند .
4) RNA های که قطبیت مثبت دارند در داخل تحت ذرات ویروسی جدیدی پوشش گذاری شده و در داخل آن رونوشت برداری می گردند . در نتیجه این رونوشت برداری مولکول های RNA با قطبیت منفی تولیده می شوند که با RNA قطبیت مثبت قبلی جفت شده تا ژنوم RNA دو رشته ای حاصل آید .
5) کپسید جدیدی بر روی این تحت ذرات ویرسی پدیدار می شود .
6) ویشه های بالغ تولیده شده پس از مرگ یاخته آلوده و پاره شدن غشای یاخته ای آزاد می شوند .
به لحاظ سرم شناسی BTV دارای 25 گروه سرمی[10] است. تمامی این گروه های سرمی BTV در یک جزء پادگنی - قابل تشخیص با روش های ثبوت مکمل ، درخشندگی ایمنی و انتشاری ایمنی[11]- مشترک هستند. ولی به هر حال آزمون های خنثی سازی ویروسی جهت تفریق این گروه های سرمی بایستی بعمل آید . توزیع و بروز هر گروه سرمی بطور دوره ای ممکن است متفاوت باشد . احتمالاً این فعالیت دوره ای گروه های سرمی ویروس ناشی از وجود ایمنیت گسترده بر علیه یک نوع گروه سرمی است که موجب غالب شدن گروه سرمی دیگری در سال بعد می شود .
همه گیر شناسی :
ویروس عامل این بیماری درجهت بقاء و ادامه حیات خود به خوبی در داخل بدن نشخوار کنندگان وحشی آفریقائی و گاو سازگاری یافته ، بطوری که نشانه های بالینی اندکی را می توان در این گونه ها مشاهده نمود. ویروس علاوه بر قابلیت تکثیر در یاخته های میزبان های حساس در یاخته های حشرات حامل نیز تکثیر می یابد . اساساً تداوم چرخه حیاتی ویروس مستلزم حضور نشخوارگنندگان (مخزن) و حشرات (حاملین) است . حشرات حامل پس از تغذیه خونی از نشخوا کنندگان مبتلا برای تمامی طول حیات خود آلوده باقی خواهند ماند. اگرچه انتقال مقاربتی و عمودی (ازطریق جفت) در نشخوارکنندگان محقق می گردد ولی این روش های انتقال در تداوم و توزیع بیماری اهمیت کمتری دارند .
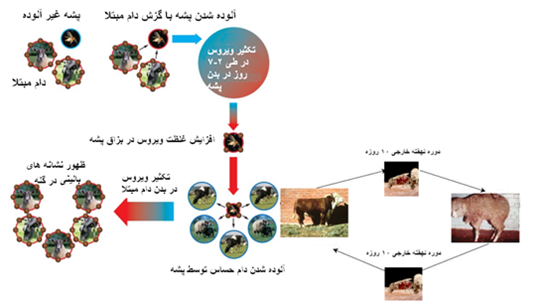
وضعیت آب و هوائی نیز نحوه توزیع جهانی
بیماری را دیکته می نماید بطوری که حضور ویروس را در یک نوار گسترده که شامل نواحی استوائی و تحت استوائی زمین مابین عرض های جغرافیائی 40 درجه شمالی و 30 درجه جنوبی می توان یافت .
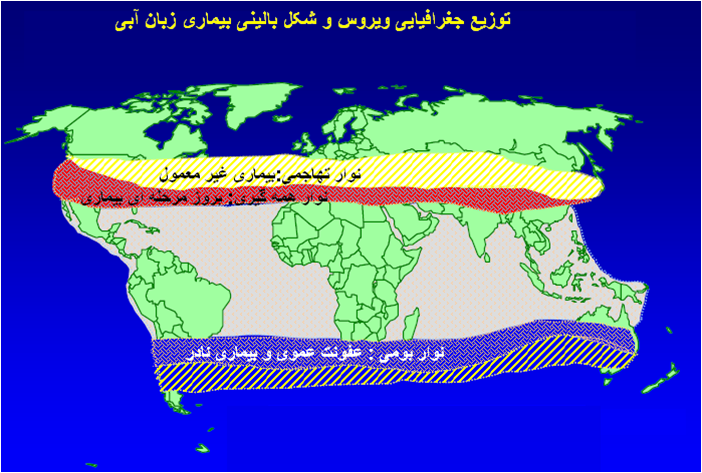
به هر حال با پراکنش ویروس در میان گوسفندان و دیگر گونه های حساس همه گیری بیماری بطور جدی بوجود می آید .اساساً یک همه گیری در جمعت گوسفندی زمانی پدیدار می گردد که 1)تعدادی از گوسفندان حساس به مناطق بومی شده بیماری وارد شده 2) یا اینکه ویروس در یک جمعیت گوسفندی حائل مناطق بومی و غیره بومی بیماری که قبلاً در معرض بیماری نبوده و نسبت به ویروس ایمنیت ندارد پخش می شود . در تحت شرایت طبیعی عفونت ویروسی را عموماً می توان در گوسفند ، بز و گاو مشاهده نمود ولی این آلودگی در گونه های دیگری نیز گزارش شده (الکها ، گوزن دم سفید ، گوزن شاخ چنگالی ، شتر ، گاومیش و دیگر نشخوارکنندگان وحشی) . در میان گوسفندان بره های شیری نسبتاً مقاوم بوده و درصورتی که میش ها مقاوم باشند ایمنی انفعالی[12] مستحکمی که تا دو ماه تداوم دارد از طریق آغوز منتقل خواهد شد . گوسفندان جوان یک ساله بیشتر ازهمه به بیماری حساس هستند. در میان نژاد های مختلف گوسفندی نژاد های انگلیسی و مرینوس حساس تر می باشند . گوسفندانی بومی که در مناطق گرمسیری و تحت گرمسیری بوده و بیماری در آن مناطق بومی است معمولاً در مقابل بیماری مقاوم هستند . همچنین کیفیت تغذیه، وضعیت ایمنی و سن دام همانند استرس های محیطی (مانند دمای بالا و تابش های ماوراء بنفش) در شدت بیماری تاثیر گذار هستند.
میزان شیوع بیماری بسته به میزان جمعیت حشرات و وضعیت ایمنی جمعیت دامی تحت اثر متنوع می باشد . با بروز بیماری در گله ای که قبلاً بیماری را نداشته میزان شیوع بیماری 50 تا 75 درصد خواهد بود و میزان تلفات نیز به 20 – 50 درصد می رسد . درسال های بعد ابتلا گله به بیماری در صورت حضور ایمنی و کاهش جمعیت حشرات با شیوع 1 تا 2 درصد تظاهر مینماید . اگر چه میزان تلفات در گوسفندان بالغ پائین است ولی ممکن است گوسفندان جوان تلفات شدیدتری داشته باشند . به هر حال همانند بیماری تب برفکی در گاو زیان های غیر مستقیم حاصله اهمیت زیادی دارند . گوسفندان بالغ دچار پشم ریزی بوده و یا پشم شکننده است . میش های آبستن ممکن است که دچار سقط شوند . تناسب پیکری به شدت کم شده و بازگشت آن خصوصاً در بره ها نیاز به زمان طولانی دارد .
ویروس این بیماری برای گاو عفونت زا بوده و تا 81 روز پس از شروع آلودگی قابل جداسازی است . نشانه های بالینی عموماً در گاو تظاهر نکرده ولی بطور طبیعی امکان بروز بیماری وجود داشته و ممکن است در میان گله های حساس منجر به تلافت نیز بشود . عدم بروز نشانه های بالینی در گاو و سایر گونه های را بایستی در تفاوت گونه ای جستجو نمود .یافته های جدید بر مبنای بررسی حساسیت یاخته های پوششی عروق که اصلی ترین جایگاه آغاز روند های آسیبی توسط ویروس می باشد نشان دهنده اختلافات اساسی بین گوسفند و گاو است . در این برسی یاخته های اندوتلیال عروق موئینه ریوی پس از جمع آوری و خالص سازی جهت کشت ویروسی بکار رفته اند، بطور جالب توجهی مشخص شد که یاخته های پوششی عروق مربوط به گاو پس از آلودگی با ویروس زبان آبی فعال شده و با افزایش روند نسخه بردای کد های ژنی انواع واسطه های التهابی و قبض عروقی دهنده تولید شده و از طرفی عرضه ملکول های جاذب (گیرنده های سطحی) در سطح یاخته افزایش می یابد، درمقایسه یاخته های پوششی مربوط به گوسفند فعالیت کمتری دارند. علاوه بر این نسبت ترمبوگزان ها به پرستاگلاندین ها (نشانگر افزایش روند انقعادی است) در گوسفند بیشتر از گاو می باشد.
بر مبنای آزمون های سرم شناسی نرخ آلودگی ممکن است تا 48% نیز برسد. وضعیت بروز بیماری در بز نیز مشابه گاو است . آلودگی طبیعی در موارد نادری بوجود آمده ، اما می توان آلودگی را بطور تجربی منتقل نمود . به نظر می رسد که تابش های خورشیدی موجب افزایش شدت بیماری شده و دیگر اشکال استرس های محیطی نیز احتمالاً ایفای نقش می نمایند.
اگرچه عفونت را به سادگی می توان با تلقیح خونی منتقل نمود ولی به نظر می رسد که در تحت شرایط طبیعی انتشار بیماری تنها از طریق گزش حشرات محقق گردیده و انتشار بیماری با تماس مستقیم امکان پذیر نیست . انواع شن مگس ها [13] (کونه های کولیکوئید) اصلی ترین حشرات حامل بیماری به شمار می روند . این حشرات در واقع بعنوان حاملین بیولوژیکی عمل می کنند . پشه آدس و ملوفاگوس اوینوس نیز از دیگر حاملین بیماری هستند . کنه های آرکازیده مانند اورنیتودوروس کوریاس اوس بطور تجربی قادر به انتقال ویروس است . اساساً حشرات کولیکوئید 10 روز پس از بلع خون حاوی ویروس آلوده می شوند . شپش گوسفند(ملوفاگوس اووینوس) به هنگام خون خواری از گوسفند مبتلا ، ویروس را دریافت می نماید و قادر است ویروس را بطور مکانیکی انتقال دهد .
بیماری دارای وقوع فصلی است . اغلب موارد بیماری در اواخر تابستان و ابتدای پائیز یعنی زمانی که جمعیت حشرات در بیشترین حد آن است تظاهر می نمایند . بیشترین میزان شیوع بیماری را در فصول مرطوب و مناطق پستی که جهت تکثیر حشرات مطلوب می باشد ،می توان مشاهده نمود . اساساً حشرات کولیکوئید بعنوان حاملین زیستی(بیولوژیک) عمل می کنند یعنی بعد از آنکه ویروس با گزش حشره وارد دستگاه گوارش شده پس از طی مرحله تکثیر و رسیدن به غدد بزاقی است که حامل فوق قابلیت انتقال بیماری را خواهد داشت . معمولاً این دوره نهفته در حشرات کولیکوئید 10 تا 14 روز می باشد . زمانی که حشره در محیطی گرم قرار می گیرد این دوره نهفته کوتاه تر می گردد .دمای محیط تاثیر فراوانی بر ادامه حیات حشره ، فعالیت تغذیه ای آن و تکثیر ویروسی در بدن حشره دارد . از این رو است که پدیده گرمایش زمین موجبات افزایش و گسترش محدوه حضور ویروس فراتر از آنچه که بوده ،گردیده.
علت تداوم فصل به فصل بیماری را می توان به تدوام بقاء ویروس در مخاذن بیماری نسبت داد . در گوسفندان بهبود یافته ویروس را می توان حتی 4 ماه پس از بیماری جداساخت ، همچنین گاو و دیگر نشخوار کنندگان وحشی بعنوان ناقلین بیماری عمل کرده و ویروس را ازفصلی به فصلی دیگر منتقل می کنند . با توجه به امکان انتقال داخل رحمی ویروس گوساله های متولد شده از گاوهای ناقل بیماری خود بعنوان یک ناقل عمل کرده و امکان انتقال ویروس به حشرات گزنده را ممکن می سازند . امکان انتقال جفت گذر بیماری در گوسفندان نیز ممکن است بطوری که می تواند به سقط جنین و ناهنجاری های جنینی منجر گردد . همچنین بدلیل بقاء ویروس در حشرات حامل در طول زمستان امکان انتقال آن ازاین راه به فصل بعد نیز قابل تامل می باشد . بدلیل اینکه گاو از پر جذبه ترین حیوانات خون گرم برای حشرات کولیکوئید است اهمیت آن بعنوان یک ناقل بیماری بیشتر مطرح می شود . جدا سازی ویروس از مایع منی گاو های نر مبتلا امکان انتقال بیماری از این طریق را نیز مطرح می سازد . بنابر این گاو بدلیل داشتن دوره طولانی حضور خونی ویروس (ویرمی) ، امکان انتقال عمودی(گذر جفتی) و جداسازی ویروس از مایع منی گاوهای نر اصلی ترین مخزن بیماری به شمار می رود .
روند بیماری زائی:

بدنبال گزش حشرات آلوده ، ویروس به غدد لنفاوی ناحیه مورد گزش مهاجرت می نماید و در این غدد اولین تکثیر ویروسی صورت می پذیرد، سپس ویروس از طریق مجاری لنفاوی به خون می رسد ، معمولاً اوج این حضور خونی 7 روز پس از تلقیح بوده و واکنش مثبت به آزمون انتشار داخل ژلاتینی [14] در روز 21 ظاهر می شود . این ویروس قابلیت تکثیری در یاخته های خونساز [15] و یاخته های پوششی عروق خونی را دارد . ویروس به میزان بسیار زیادی محدود در گویچه های سرخ خونی و یاخته های خونی است ، از این رو تصور می شود که جایگاه اصلی تکثیر ویروسی یاخته های اجدادی مغز استخوان گاو می باشد . به دلیل جای گیری ویروس در داخل یاخته های خونی (گویچه های سرخ و پلاکت ها) است که ویروس قابلیت همزیستی با پادتن های خنثی گر ویروسی را در طبیعت دارد . بدنبال این حضور خونی اولیه ویروس در بافت پوششی عروقی [16] موضعی می گردد. ویروس در این یاخته های پوششی شروع به تکثیر کرده (دومین مرحله تکثیر ویروسی) و مجدداً وارد خون شده تا دومین مرحله حضور خونی ویروس را پدید آورد. این ویرمی ثانویه در مقایسه با ویرمی اولیه طولانی تر بوده و موجب تداوم آلودگی در دام مبتلا می شود . با تکثیر ویروس در یاخته های بیگانه خوار تک هسته ای و پوششی عروق(اندوتلیوم) روند تولید سیتوکین های التهابی و همزمان با آن روند مرگ یاخته ای [17] آغاز می گردد ، نتیجه رخداد های فوق بروز التهاب عروقی منجر به ادم می باشد و نهایتاً با تخریب و پاره شدن این دیواره عروقی ضایعات پوششی مشخصه این بیماری ایجاد گردیده و گاهی در بافت های پوششی و سطوح مخاطی نکرز را در پی دارد .ویروس می تواند بدون تکثیر در داخل یاخته های خونی باقی مانده و موجبات تداوم آلودگی خونی تا 5 ماه نیز بشود .
نشانه های بالینی شدیدی که در تعداد اندکی از گاو ها ظاهر می گردد در واقع نوعی واکنش ازدیاد حساسیت است . ویروس از طریق گردش خون به ارگان های مختلف بدن می رسد . حضور ویروس در مایع منی همراه است با بروز اختلالات ساختاری در اسپرماتوزوآ ها . هر دو نوع ویروس طبیعی و کشت بافتی در لایه های جفتی نفوذ کرده و موجب بروز عفونت مادر زادی در جنین می گردند . اختلالات مادرزادی ناشی از ویروس تخفیف حدت یافته در بره ها معمولاً در سامانه عصبی تظاهر می نماید ،ویروس در واقع سبب قطع روند اندام زائی می شود که وقوع این اختلال با ویروس طبیعی امری نادر است . اختلال فوق در بره ها عموماً در مراحل اولیه آبستنی پی ریزی می شود . موقعیت و طبیعت این ضایعات در ارتباط با سطح بلوغ یافتگی و میزان مهاجرت یاخته های فوق در هنگام عفونت ویروسی است . طبیعت استحاله ای ضایعات حاصله ناشی از حضور یاخته های عصبی نابالغ توام با افزایش حساسیت ویروسی است که همراه است با عدم توانائی در بسیج یک پاسخ ایمنی موثر . ایجاد آلودگی طبیعی در میش های آبستن منجر به تهاجم ویروس در جنین شده که موجب مرگ جنین می شود . این تهاجم ویروسی به جنین 6 تا 7 روز بعد از آلودگی صورت گرفته و توام است با یک نکروز کبدی گسترده به همراه کاهش روند خون سازی کبدی. آلایش میان دوره ای آبستنی منجر به بروز عفونت در بره ها شده بطوری که این بره ها فاقد ضایعات یاد شده بوده و به گونه طبیعی متولد می شوند .این بره ها آلوده به ویروس بوده و می توانند بعنوان منبع عفونت (تا 2 ماه) در گله باشند . انتقال عمودی ویروس در گاو نیز محقق می گردد . آلایش داخل رحمی گاو ها در مرحله 60 تا 120 روزگی آبستنی با ویروس حاد موجب پیدایش نواقص مادر زادی می شود که عبارتند از : افزایش بافت لثه ، فقدان فک پائینی [18] اسپاسم کزازی مفاصل [19] ، عدم تعادل و فشاردادن سربه موانع سخت . آب آوردگی مغزی [20] نیز گاهی دیده می شود .
نشانه های بالینی:
بیماری زبان آبی به لحاظ بالینی بصورت دو نوع نشانگان تظاهر می نماید .1) درگیری سامانه عروقی در چند ارگان از بدن دام و 2) نشانگان تولید مثلی . در گوسفند بیماری عمدتاً بصورت بالینی تظاهر داشته ولی در دیگر نشخوار کنندگان اهلی چون گاو و بز نشانه های بالینی ندرتاً مشاهده می گردد .
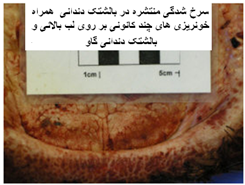
بیماری در گاو غالباً نامشهود است ، اگر چه در تعداد کمی از گاو های مبتلا نشانگان بالینی غیر مشابهی با گوسفندان به شدت مبتلا تظاهر می نماید . نشانگان بالینی معتبری که بروز می کنند عبارتند از : تب 40-41 در جه سانتی گراد، خشک شدگی و لنگش در چهار پا ، افزایش تراوش بزاقی ، ادم لب ها ، بی اشتهائی ، ترشحات بینی و بوی متعفن تنفسی . همچنین در برخی از گاو های مبتلا ضایعات زخمی شونده بر روی زبان ، بالشتک دندانی و پوزه ایجاد می گردد . گاهی ممکن است التهاب حاد نوار تاجی سم به همراه افتادن سم دیده شود .ممکن است در مواردی ترشحات سروزی خون رنگ در سوراخ های بینی و بروز ترشحاتی را از چشم دید . این شکل گلگون از بیماری ظاهراً ناشی از واکنش ازدیاد حساسیت در گاوهائی است که قبلاً به بیماری مبتلا بوده اند (ولی در گوسفند اینگونه نیست).


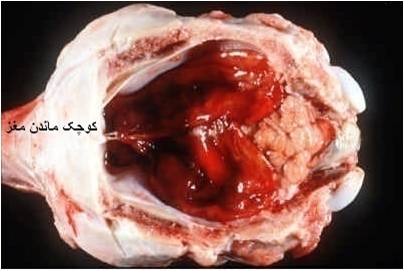
ایجاد آلودگی در مراحل اولیه آبستنی ممکن است منجر به سقط جنین شده یا ناهنجاری های مادر زادی را درپی داشته باشد ، این ناهنجاری ها عبارتند از آب آوردگی مغزی [21]، کوچک ماندن مغزی[22] ، انحناع یافتگی پاها، کوری و بد شکلی های آرواره ای.

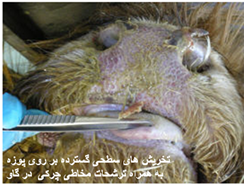
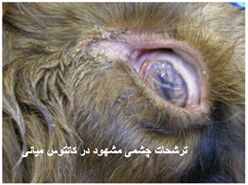
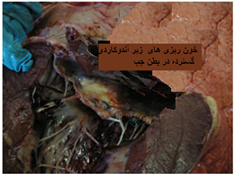
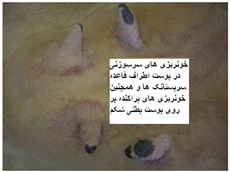
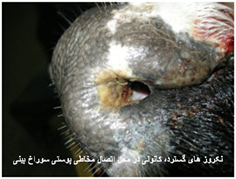
بیماری در گوسفندان یک آلودگی تحت بالینی ، ملایم یا شدیدی را که می تواند در برخی از گله ها تا 50 درصد نیز برسد شامل می شود ، میزان تلافات پائین بوده ولی بستگی به حدت ویروس ، بهداشت و مدیریت گله و عوامل محیطی اثر گذار چون بالا بودن دمای محیط دارد. به هنگام اولین مرحله روبرویی گوسفندان حساس با گروه های سرمی حاد ویروس نشانگان بالینی مشخصی ایجاد می شود . این نشانگان را به راحتی نمی توان با آلودگی های تجربی ایجاد نمود. بیماری پس از یک دوره نهفته کمتر از یک هفته ای ( 2-4 روز) ظاهر می شود . دام مبتلا معمولاً دچار یک واکنش تب شدید با حداکثر دمای 5/40 تا 41 درجه سانتی گراد است . البته مواردی از عدم بروز تب را نیز می توان مشاهده نمود. تب حاصله به مدت 5 یا 6 روز دوام دارد . حدوداً 48 ساعت پس از اوج گیری دمای بدن ترشحات بینی و بزاقی را به همراه سرخ شدگی مخاطات دهانی و بینی می توان دید . ترشحات بینی ، مخاطی چرکی بوده ومعمولاً خون رنگ هستند و از طرفی ترشحات بزاقی حالت کفی دارند . تورم و آماس در لب ها ، لثه ، بالشتک دندانی و زبان بودجود می آید . بدنبال این تورم تخریش هائی در مخاطات دهانی حاصل آمده و بزاق خون رنگ می شود . با بروز این رخداد ها دهان بوی نامطلوبی به خود می گیرد . زخم های نکروزه عدسی شکلی – خصوصاً بر روی سطوح جانبی زبان - ایجاد می شود بطوری که متورم و ارغوانی رنگ هستند . در غالب موارد عمل بلع به سختی صورت می گیرد . تنفس در وضعیتی انسدادی و خرناسی انجام شده و سرعت آن تا 100 بار در دقیقه افزایش می یابد . در مواردی اسهال عادی یا اسهال خونی بروز می کند . تنها در برخی از موارد ناحیه پا نیز دچار ضایعاتی می شود که عبارتند از التهاب بافت مورق سم و نوار تاجی سم که با لنگش و زمین گیری تظاهر می نماید . این تظاهرات ناحیه پا معمولاً زمانی که ضایعات دهانی شروع به بهبود کرده اند مشاهده می گردند . ظهور نوارهای قرمزه تیره تا ارغوانی رنگ در قسمت پوستی فوقانی و مجاور ناحیه تاج سم از مهمترین نشانه های تشخیصی است . گردن کج شده با سر وگردن پیچ خورده به یک سمت در تعداد کمی از مبتلایان دیده می شود این حالت را در حدود روز 12 ابتلا بطور ناگهانی می توان مشاهده کرد . تناسب پیکری [23] بطور آشکار و سریع ازدست می رود . قسمت های پائینی صورت ، گوش و فک متورم بوده و ممکن است بخش های بدون پشم پوست پرخون باشند . در برخی از گوسفندان مبتلا ملتحمه ملتهب بوده و همراه با آن ترشحات اشکی به وفور ایجاد می شود . تار های پشم شکننده می باشد . استفراغ و پنومونی استنشاقی ثانویه نیز ممکن است بوجود آید . در بیشتر موادری که منجر به مرگ شده تلافات 6روزپس از بروز نشانه های بالینی است .دوره بهگرائی[24](نقاهت) معمولاً طولانی بوده و برگشت به وضعیت عادی چند ماه طول می کشد . ریزش کامل یا نسبی پشم در غالب موارد دیده می شود . دیگر نشانه های مربوط به دوره بهگرائی عبارتند از ایجاد ترک در سم یا جداشدن کامل آن ، بروز چین و چروک و ترک در پوست اطراف لب ها و پوزه .
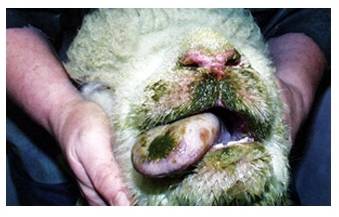

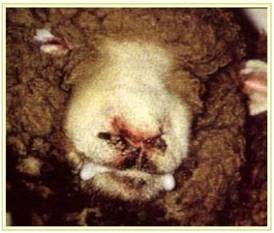
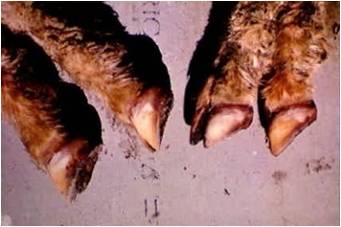
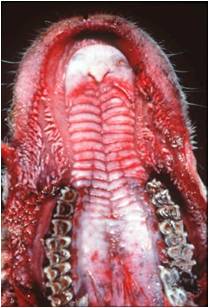
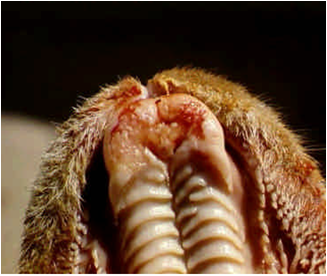
در گوسفندان نواحی که بیماری در آن بومی است[25] بیماری کمتر بصورت حاد بروز کرده و در غالب موارد پنهان است. در این مناطق بیماری بصورت دو نوع نشانگان تظاهر می کند . یکی شکل سقط جنینی که در گوسفندان مبتلای دارای تب بدون ضایعات موضعی بروز می کند و دیگری شکل تحت حاد بیماری که در آن ضایعات ایجاد شده اندک بوده ، اما لاغری ، سستی و ضعف شدید با دوره بهگرائی طولانی مشهود است . نشانگان مشابهی را نیز می توان در بره های که ایمنی غیرفعال را از طریق آغوز گرفته اند و در معرض آلودگی هستند یافت .
بز های آلوده تظاهرات بالینی اندکی را نشان می دهند . تب خفیف تا ملایم بوده و پرخونی در مخاطات و ملتحمه دیده می شود .
در گوزن ها بیماری زبان آبی تحت عنوان بیماری خونریزی دهنده همه گیر[26] (EHD) شناخته می شود که مشابه گوسفندان است ( ویروس این بیماری با ویروس زبان آبی واکنش متقاطع دارد) . گوزن ها نسبت به ویروس زبان آبی فوق العاده حساس بوده بطوری که با تکثیر ویروس در یاخته های پوششی عروق (اندوتلیال)، یاخته های فوق دچار آسیب شده و آسیبهای انعقادی تحلیلی برند منجر به انعقاد داخل رگی گسترده می گردند. این انعقاد داخل رگی گسترده موجب بروز خونریزی در گوزن مبتلا می شود. همچنین تخریب های عروقی حاصله مسئول افزایش نفوذ پذیری عروقی بوده که منجر به ادم در بافتها می شود بعنوان مثال در ریه ها ادم ریوی را در پی دارد .همچنین تخریب های عروقی ترمبوز عروقی را بدنبال دارد که خود موجب قطع خون رسانی[27] به بافت های می شود که خونرسانی آنها از این عروق درگیر بوده . حیوانات مبتلا دچار تورم و خونریزی از ناحیه سر ، گردن ، زبان و چشم هستند . گوزن مبتلا در طی 3تا 4 روز تلف می شود .

تشخیص آزمایشگاهی:
تشخیص قطعی بیماری با تلقیح خون آلوده به گوسفند حساس ، موش سفید از شیر گرفته یا هامستر محقق می گردد . بهترین زمان نموه گیری از خون دام در مرحله تب دار است . خون اخذ شده بایستی با یک ترکیب ضد انعقادی در مجاورت یخ(دمای یخچالی) به آزمایشگاه ارسال گردد. همچنین می توان ویروس را با کشت در محیط کشت بافتی یا تخم مرغ جنین دار تشخیص داد . شماری از آزمون های تشخیصی سرمی جهت تائید آلودگی نیز قابل اجرا می باشد که عبارتند از : آزمون مستقیم ثبوت مکمل تغییر یافته [28]، آزمون ریزرسوبی[29] بر روی ژل آگار ، شیوه پادتن درخشان[30] ، آزمون خنثی سازی احیاء شده پلاکی[31] ، آزمون جاذب ایمنی متصل به آنزیم (الیزا) ، انتشار ایمنی [32] ، ارزیابی تشعشعی ایمنی [33] و ارزیابی همولیز داخل ژل[34] . تمامی آزمون های یاد شده تقریباً ارزش تشخیصی یکسانی دارند ولی در مقایسه آزمون خنثی سازی احیاء شده پلاکی حساس تر می باشد .
باز تاب آسیب های عضلات اسکلتی بوجود آمده در این بیماری با افزایش میزان سرمی برخی از آنزیمها قابل پیگیری است، این آنزیم عبارت است ازکراتین فسفوکیناز .تابلوی خونی در مراحل اولیه بیماری حاکی از افزایش ملایمی در میزان گویچه های سفید خونی است(لوکوسیتوز) که متعاقب آن تعداد این یاخته ها بطور بارزی کاهش می یابد (لوکوپنی) و عمده دلیل این کاهش نیز نقصان تعداد گویچه های سفید لنفاوی است (لنفوپنی) . گاو های آلوده نیز یک لوکوپنی را نشان می دهند .
جهت جداسازی ویروس ، خون تامی که تازه اخذ گردیده با هپارین و در مجاورت یخ به آزمایشگاه ارسال می گردد . همچنین می تواند به این منظور از نمونه های بافتی (طحال، غدد لنفاوی ، کبد ،خون قلب ، مغز استخوان) تازه که از گوسفندی که اخیراً تلف شده استفاده نمود، این نمونه ها بایستی در دمای 4 درجه سانتی گراد( بدون انجماد) نگهداری شوند . نمونه های سرمی را جهت آزمون الیزای رقابتی یا انتشار ایمنی داخل آگار ژل می توان بکار برد ، در نمونه گیری سرمی بایستی همواره دو نمونه همزمان اخذ گردیده تا افزایش عیار پادتن مشخص گردد .
یافته های کالبد گشائی:
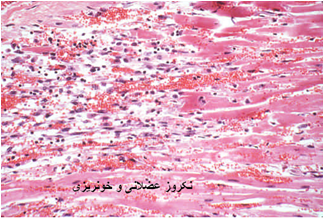
اساساً در کالبد گشائی ضایعه ای که بطور مشخص و بارز دلالت بر بیماری داشته باشد را نمی توان عنوان کرد ، در برخی موارد ممکن است که هیچ نوع نشانه کالبد کشائی دیده نشود درحالی که در غالب موارد خونریزی در تعدادی از اندامها (خصوصاً قلب) وجود دارد . علاوه بر ضایعات پوستی و مخاطی که عنوان گردید ضایعات دیگری مشتمل بر ادم سرتاسری ، پرخونی ، خون ریزی و نکروز در عضلات اسکلتی و قلبی وهمچنین پنومونی استنشاقی را می توان دید .ادم سراسری بصورت یک آماس زیر جلدی ژلاتینی است که نواحی سر ، گردن ، پاهای قدامی و تنه را در بر می گیرد . در غالب موارد یک خون ریزی مشخص در قاعده سرخ رگ ریوی مشهود است . مخاط شیردان پرخون و ادماتوز بوده که گاهی به همراه آن خونریزی های کشمشی و زخم نیز دیده می شود . ضایعات آسیب شناسی در عضلات شامل خون ریزی و استحاله هیالینی است . در گوسفند غالب تلفات ناشی از پنومونی ناشی از عفونت های ثانویه باکتریائی است که در کالبد گشائی بصورت پنومونی دو طرفی شدید تظاهر می نماید . دیگر یافته های پس از مرگ شامل خونریزی در قلب ، تورم و نکروز عضلات ، تورم غدد لنفاوی و تورم و پرخونی در طحال می باشد. همچنین خونریزی های سرسوزنی و کشمش در زیر زبان ، بر روی کام سخت ، مری ،پیش معده ، غدد لنفاوی ، مثانه و طحال نیز دیده می شود .
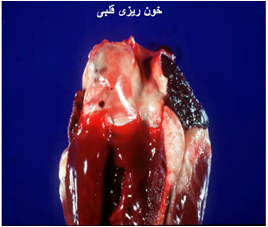
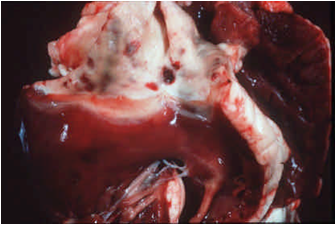
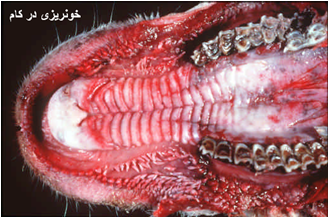
تشخیص تفریقی:
اگر چه شاخص های همه گیری بیماری زبان آبی و طبیعت انتقال حشره ای [35] آن بیماری را از دیگر موارد متمایز می سازد ولی ممکن است در مواردی دچار خطا و اشتباه شد . این موارد عبارتند از بیماری تب برفکی ، اکتیمای واگیر ، درماتیت زخم شونده ، آبله گوسفندی ، بیماری ایباراکی[36](یک بیماری همه گیر در گاو) ، تورم دهان قارچی ، ازدیاد حساسیت نوری و آلودگی با حشرات بینی ،تورم تاولی دهان ، طاعون نشخوارکنندگان کوچک(PPR) ، پنومونی، عفونت آکابان ،ورم مفصلی چندگانه ، فوترات ، آبسه های پا ، مسمومیت گیاهی .
بیماری زبان آبی وقوع فصلی داشته و به هنگام کاهش جمعیت حشرات حامل بیماری ناپدید می شود .آزمون های سرم شناس این امکان را فراهم می آورند که بیماری را از دیگر موارد تمیز داد . همچنین می توان با تزریق خون دام آلوده (در مرحله تب دار) به گوسفند حساس دیگری ضمن مشاهده نشانه های بالینی ویروس بیماری را نیز از گوسفند مورد آزمایش جدا ساخت. انجام این تلقیح در تخم مرغ جنین دار و محیط کشت یاخته ای نیز امکان پذیر است . اکتیمای واگیر و درماتیت زخم شونده دارای ضایعت مشخصی هستند .آبله گوسفندی بیماری با تلافات بالا بوده و ضایعات آبله ای آن کاملاً متمایز است . بیماری ایباراکی که شبیه به زبان آبی است ، در ژاپون دیده شده و عامل ویروسی آن به لحاظ پادگنی از ویروس زبان آبی متفاوت است . بیماری به لحاظ بالینی با تب بالا ، التهاب دهان زخمی شوند و دشواری بلع مشخص می گردد . پرخونی و ادم مخاطات توام است با خونریزی (مشابه گاو) .
جنبه های بهداشت عمومی:
هیچ مورد گزارشی مبنی بر امکان ابتلای انسانی به این بیماری وجود ندارد .
درمان بیماری:
اصول کلی درمان حمایتی است و اساساً هیچ نوع ترکیب پادزیستی موثری بر علیه ویروس زبان آبی وجود ندارد . درمان بیماری مبتنی بر استراحت و محافظت دام از تغییرات نامناسب آب وهوائی- خصوصاً در معرض آفتاب سوزان بودن- است. درمان های اعمال شده نیز در جهت کنترل عفونت های ثانویه باکتریائی است که معمولاً ترکیبات سولفانامیدی توصیه می شود . بکار گیری محلول هائی از ترکیبات ضد عفونی کننده ملایم ممکن است در تسکین بیماری موثر باشد . از آن جهت که دام مبتلا به جهت ضایعات دهانی قادر به دریافت غذا نیست بایستی از لوله های معدی به این منظور استفاده کرده ویا از علوفه نرم بهره جست . به دلیل ضایعات نوارتاجی سم و کاهش تحرک دام آب و غذا بایستی در دسترس قرار بگیرد.
کنترل و پیشگیری:
با توجه به طبیعت انتشار بیماری بر مبنای حامل بند پا و ناقلین زنده اعمال سیاست های قرنطینه ای یکی از اصولی ترین راهکارهای کنترلی به شمار می رود. سیاست های کنترلی مبتنی بر نظارت در مناطق محدود شده[37] و پایش[38] در مناطق خارج محدوده است. برنامه های نظارت و پایش بایستی شامل ارزیابی های بالینی ، سرم شناسی وحشره شناسی باشد. در نواحی غیر درگیر که اساساً سدهای طبیعی ورود خارج از کنترل دام را محدو می نمایند ممانعت از بروز بیماری بستگی به مقررات قرنیطنه ای و اقدامات پیشگیرانه از ورود هوابردی حشرات حامل دارد. ورود اسپرم بایستی پس ازآزمایش دام دهند و نگهداری طولانی اسپرم خریداری شده اجرایی گردد . در مناطقی که بیماری بومی است هر اقدامی که انتقال هوابردی حامل بیماری را محدود می سازد می تواند به کاهش انتشار بیماری منجر گردد. به هر حال تغییرات ساده ای در روش های نگهداری دام و اقدامات پیشگیرانه کنترلی در خصوص محدود سازی حشرات ممکن است به قطع چرخه آلودگی دام منجر شود . استفاده از ترکیبات دافع حشره ، نگهداری شبانه در جایگاه بسته و اجتناب از ورود دام به نواحی پست و باتلاقی در طی اوج گیری جمعیت حشرات می تواند به کاهش میزان گزش توسط حشرات منجر گردد. تمایل حشرات به گاو در مقام مقایسه با گوسفند بیشتر است لذا استفاده از گاو بعنوان هدف انحرافی جهت کاستن از آلایش انگلی در گوسفندان مجاور شیوه مناسبی خواهد بود. پشه های کولیکوئید حامل ویروس معمولاً در مدفوع دام و خاک های مرطوب تولید مثل می نمایند ، تعین زمین هائی که این تکثیر در آنها انجام می شود و اقدام به قطع چرخه انگلی در آن می تواند به کاهش جمعیت پشه های فوق منجر شده که خود به کاهش انتشار بیماری کمک می نماید ،این اقدامات می تواند شامل خشک نکهداشتن این بخش ها با جمع آوری و خارج سازی هفتگی گود باشد .تجربه نشان داده است که در تحت برخی شرایط تاثیر گزاری مقررات کنترلی در خصوص تضمین پیشگیری از تهاجم حشرات حامل تحت تاثیر مجمومه ای از عوامل می باشد که عبارتند از گونه های جدیدی از حشرات حامل ، شرایط آب و هوائی و نوع پروش . روشن گری اطلاعات جدیدی علمی در خصوص روند بیماری زائی ویروس زبان آبی که مربوط به امکان انتقال بیماری با گذر جفتی عامل ویروسی است ، ضرورت اعمال مقراتی را درخصوص پیشگیری ازامکان انتشار توسط دام های آبستن را مطرح می سازد.
انجام مایه کوبی تنها راه مقابله موثر از بروز بیماری در مناطقی است که بیماری در آن شیوع یافته . انجام مایه کوبی های دوره ای مکرر در این نواحی اگر چه نمی تواند بیماری را ریشه کن نماید ولی راه موثری در کاستن میزان تلفات بیماری است ،البته بایستی همواره سویه های ویروسی موجود در منطقه شناسائی شده و میزان شیوه آنها مشخص گردد . مشکل اساسی در برنامه های کنترلی حضور ناقلین نامشخص در میان نشخوارکنندگان وحشی است که انجام مایه کوبی (تزریقی) تنها راه کنترل در این جمعیت بوده که خود امری دشوار می باشد . واکسن غیر فعال شده یا زنده تخفیف حدت یافته را می توان برای مایه کوبی بکار برد . معمولاً واکسن غیرفعال را درمناطقی که بیماری بومی شده استفاده نمی کنند. یک نوع واکسن تخفیف حدت یافته در آمریکا برای مایه کوبی گوسفند بکار می رود که تنها حاوی گروه سرمی نوع 10 می باشد . همچنین یک واکسن چندگانه تخفیف حدت یافته (برای چهار نوع گروه سرمی) نیز تهیه شده که برای مایه کوبی نشخوار کنندگان استفاده می شود . در آفریقا یک واکسن تخفیف حدت یافته چندگانه تهیه شده بر روی تخم مرغ نیز وجود دارد که به جهت دارا بودن شماری از سویه های ویروسی طیف پادگنی گسترده ای دارد، واکنش در مقابل واکسن ناچیز بوده ولی نبایستی میش ها را تا هفته سوم جفت پذیری با آن مایه کوبی نمود . تکرار واکسن بطور سالانه و 1 ماه پیش از وقوع بیماری بایستی محقق گردد. ایمنیت کافی 10 روز پس از مایه کوبی حاصل می آید بطوری که انجام مایه کوبی در آغاز یک همه گیری می تواند از میزان تلفات بکاهد . بره های مربوط به میش های ایمن ویروس تخفیف حدت یافته را خنثی نموده و از این رو پاسخ ایمنی مناسبی را با دریافت واکسن کسب نمی کنند ، در حالی که سویه های طبیعی ممکن است که بر ایمنی غیر فعال فوق فائق آیند. از این رو در مناطقی که بیماری بومی است ضرورت دارد که بره زائی به گونه ای تنظیم شود که تا پس از گذشت مرحله خطر ناک بیماری زایش های صورت پذیرد و مایه کوبی بره ها بایستی تا 2 هفته پس از شیری گیری به تعویق افتد . گزارش های مبنی بر اینکه مایه کوبی با واکسن فوق موجب بروز بدشکلی هائی در بره ها گردیده وجود دارد .مرحله خطر ناک بین هفته چهارم و هشتم آبستنی است ، بیشترین شیوع ناهنجاری در مایه کوبی زمانی وقوع می یابد که میش های 5 تا 6 هفته آبستن واکسن را دریافت می کنند . این ناهنجاری عبارتند از : بدقوارگی شبکیه [39] ، حالت انقباضی و ادم پاها و نشانگان گنگی[40] . این بره ها در کالبد گشائی هیچ نشانه ای از عفونت باکتریائی یا ویروسی ندارند . حفره جمجمه مملو از مایعات بوده و مغز رشد اندکی داشته که توام است با تغییرات استحاله ای . ضایعات مشابهی را نیز می توان در گوساله های که با ویروس حاد آلوده شده اند مشاهده نمود .
در اروپا یک واکسن زنده تخفیف حدت یافته که حاوی ویروس گروه سرمی نوع 8 است بکار می رود . همچنین در آلمان توسط شرکت Fort Dodgeواکسنی نیز برای مایه کوبی گاو ساخته شده .
[1] arthropod-borne
[2] Arthropod-born disease
[3] Catarrhal stomatitis
[4] Reoviridae
[5] Orbivirus
[6] Non-turreted
[7] Replication
[8] assembly
[9] morphogenesis
[10] serotype
[11] Immunodiffusion
[12] Passive immunity
[13] Sandflies
[14] Gel diffusion test
[15] Hematopoietic cells
[16] Vascular endothelium
[17] apoptosis
[18] Agnathia
[19] Arthrogryposis
[20] Hydranencephaly
[21] Hydranencephaly
[22] Microcephaly
[23] Condition
[24] Convalescence
[25] Enzootic areas
[26] Epizootic hemorrhagic disease
[27] infarction
[28] Modified direct complement fixation test
[29] Microprecipitation test
[30] Fluorescent antibody
[31] Plaque reduction neutralization test
[32] Immunodiffusion
[33] Radioaimmunoassay
[34] Hemolysis-in-gel assay
[35] Insect-borne
[36] Ibaraki disease
[37] monitoring
[38] surveillance
[39] Retinal dysplasia
[40] Dummy syndrom
