تب دره ریفتRift Valley Fever (RVF)
تب دره ریفت
Rift Valley Fever (RVF)

تعریف:
بیماری تب دره ریفت یک عفونت ویروسی منجر به تب است که بطور اولیه سبب درگیری دامهای اهلی شده ولی قادر است به انسان نیز منتقل گردد . بدلیل قابلیت بالا در انتشار سریع ، پی آمدهای جدی اقتصادی و بهداشت عمومی، بعنوان یکی از بیماری های گروه A در لیست 15 عامل بیماری زای پیشنهادی توسط دفتر بین الملل بیماری های همه گیر دامی(OIE ) آمده است . بیماری با گزش پشه های آلوده به ویروس (خصوصاً آدس و کولکس) منتشرمی شود . عفونت ناشی از عامل این بیماری موجب ناخوشی شدیدی در انسان و دامهای مبتلا می شود بطوری که بیماری با میزان ابتلا و تلافات بالا تظاهر می نماید . همچنین این بیماری به جهت مرگ و سقط جنین در میان گله مبتلا زیانهای اقتصادی معنی داری را در پی دارد . بیماری تب دره ریفت یکی از چندین مورد بیماری های بوده که تا پیش از لغو برنامه های سلاح های زیستی ایلات متحده مورد برسی و تحقیق محققین قرار داشته و امروزه بعنوان یک صلاح ترر زیستی [1] مطرح است . توجه به این عامل ویروسی بعنوان یک سلاح زیستی بدلایل ذیل می باشد:
- این ویروس قادر است بصورت ذرات معلق و بسرعت پراکنده گردد(نیم عمر ویروس بصورت ذرات معلق در دمای 25 درجه سانتیگراد و رطوبت نسبی 30 برابر 75 دقیقه است .
- دوز عفونی ویروس کم می باشد ( حداقل میزان دوز ویروس جهت بروز بیماری اندک است).
- میزان شیوع و تلفات ناشی ازاین عفونت ویروسی زیاد است ( میزان شیوع در انسان ممکن است تا 10 درصد یک جمعیت غیر بومی برسد) .
- ویروس قابلیت ایجاد ترس و وحشت در بهداشت عمومی را دارد.
- واکسن های موثر به منظور کنترل بیماری هنوز برای مقاصد بهداشت عمومی دردست نیست .
- ویروس بیماری زا در دسترس بوده و بسادگی درمقادیر زیاد قابل تکثیراست .
تاریخچه بیماری :
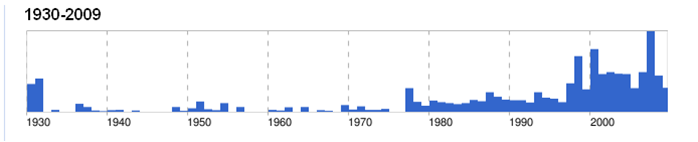
بیماری برای نخستین بار در سال 1931 در کشور کنیا بصورت یک بیماری با دوره نهفته کوتاه ، تب ، التهاب کبدی ، تلافات بالا در بره های کمتر از یک هفته سن و نرخ بالای سقط جنین در گله مشخص گردید . بیماری توسط ویروسی که بعدها ویروس تب دره ریفت نام گرفت ایجاد می شد و عامل فوق توسط پشه ها منتقل می گردید . در سال های اولیه پیدایش ، بیماری محدود به قاره آفریقا بود و خصوصاً در شرایط رطوبی ( فصول بارانی) تلفات زیادی را در جمعیت دامی موجب می شد . در سال 2001 میلاد بیماری از عربستان سعودی و یمن نیز گزارش گردید . شکل انسانی بیماری اگر چه ندرتاً موجب مرگ می شد ولی ناتوانی موقت و ضعف فیزیکی را درپی داشت . همه گیری بیماری در سال 1951 در آفریقای جنوبی با درگیری تخمینی20000 نفر و تلفات 100000 گوسفند و گاو همراه بود . در سال 1977 در مصر ابتلای 18000 نفر با مرگ 698 مورد انسانی بوقوع پیوست . همچنین مواردی از همه گیری ها در منطقه دلتای نیل ، مصر در سال 1978 و 1993، در حوزه آبگیری پائینی رودخانه سنگال کشور موریتانی در سال 1987 و همه گیری های گسترده ای در کنیا و تانزانیا در سال 1997 و 1998 گزارش شده . همه گیری این بیماری در جنوب غربی عربستان صعودی و یمن به سال 2000-2001 برای اولین بار در خارج از آفریقا گزارش گردیده.
سبب شناسی بیماری:
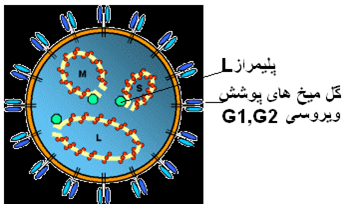
عامل بیماری ویروسی است از خانواده بنیاویریده(Bunyaviridae) جنس فلبوویروس (Phlebovirus) ، پوشش دار ، بدرجاتی چندریخت [2] ، با قطری در حدود 80 تا 120 نانومتر . محتوای ژنومی این نوع ویروس RNA تک رشته ای با قطبیت منفی (single-stranded negative-sense) خود متشکل از سه قطعه با نام های قطعه کوچک (S) به طول 1690 جفت باز، قطعه متوسط (M) به طول 3885 جفت باز و قطعه بزرگ (L)به طول 6606 جفت بازاست . قطعه بزرگ (L) حاوی یک ژن بوده که پلیمراز ویروسی L(RNA پلیمراز وابسته بهRNA ) را رمزگذاری می نماید ، قطعه متوسط(M) شامل دو ژن بوده که پیش ساز های گلیکو پروتئینی سطحی سازنده گل میخ های[3] پوشش ویروسی (G1,G2) و پروتئین های غیر ساختاری 14 و 78 کیلو دالتونی را رمزگذاری می کند و نهایتاً قطعه کوچک(S) حاوی دو ژن بوده که پروتئین نوکلئوکپسیدی N و پروتئین غیر ساختاری NSs را با راهکاری دو قطبی[4] رمز گذاری می نماید. در هر ویشه ویروسی هر کدام از این قطعات ژنومی توسط یک پوشش پروتئینی نوکلئو کپسیدی مجزا احاطه می شوند تا ساختار ریبونوکلئوکپسیدی را ایجاد نمایند. نوکلئو کپسید و RNA پلیمراز وابسته به RNA در یک پوشش لیپیدی که حاوی گلیکوپروتئین های ویروسی G1 و G2 است بسته بندی می گردند . اصلی ترین جایگاه تکثیر ویروسی در بدن میزبان کبد و طحال بوده و از طرفی مغز نیز خصوصاً در جنین و نوزادان یک جایگاه عمومی تکثیر به شمار می رود . مراحل تکثیر ویروس در شکل زیر ارائه شده .
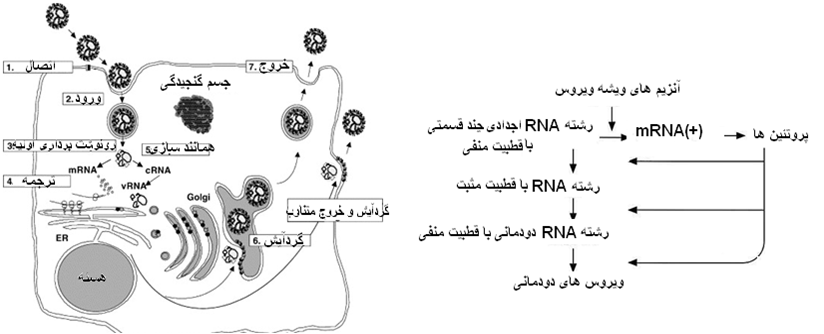
مراحل تکثیر ویروسی و الگوی مربوطه
در آغاز ویشه های ویروسی(ویریون) توسط گیرنده های سطحی یاخته میزبان و گل میخ های سطح ویروس به این یاخته متصل می شوند. بدنبال این اتصال و با فعال شدن روند آندوسیتوز در نتیجه ادغام غشاهای یاخته و ویروس ویشه های ویروسی بداخل یاخته میزبان وارد شده که بدنبال این رخداد ریبونوکلئوکپسید ویروسی و RNA پلیمراز وابسطه به RNA ویروس در سیتو پلاسم یاخته رها می شوند . در سیتوپلاسم یاخته رونوشت برداری اولیه از ژنوم ویروسی صورت گرفته و بدنبال آن با ترجمه این رمزهای ژنتیکی منجر به تولید پروتئین های ویروس در داخل سیتوپلاسم می شود . با تولید پروتئین های ویروسی روند همانند سازی ژنوم ویروسی آغاز می گردد ، در ابتدا یک همانند واسط (cRNA) با قطبیت مثبت تولید می گردد که از طریق این ژنوم واسط ژنوم اصلی (vRNA) همانند سازی می گردد. بدنبال این همانند سازی ژنومی و تولید پروتئین های ویروسی کلیه اجزای سازنده ویروس در داخل سیتوپلاسم مهیا گشته و روند گردآیش ویروسی [5] درغشای دستگاه گلژی انجام شده و ویروس کامل با روند تشکیل جوانه و کسب بخش از غشای دستگاه کلژی بداخل سیتوپلاسم وارد می گردد (در برخی از ویروس های این خانواده گردآیش و جوانه زنی در غشای یاخته صورت می گیرد) . ویروس های کامل داخل سیتو پلاسم نیز متعاقباً با روند اگزوسیتوز که در نتیجه ادغام غشای پیرامونی ویروس و یاخته فعال شده به خارج از یاخته رها می گردند .
ژنوم چند قطعه ای بنیاویروس ها همانند ویروس های آنفولانزا بواسطه نوترتیبی(باز ترتیبی) [6] قطعات ژنومی قابلیت انتقال پادگنی دارند . این پدیده نوترتیبی منجر به ظهور سویه های جدیدی می شود که از نظر ایمنی شناسی خام و ساده هستند . بنابر این بایستی در خصوص کنترل و مراقبت از ویروس های این خانواده دقت کافی نمود .
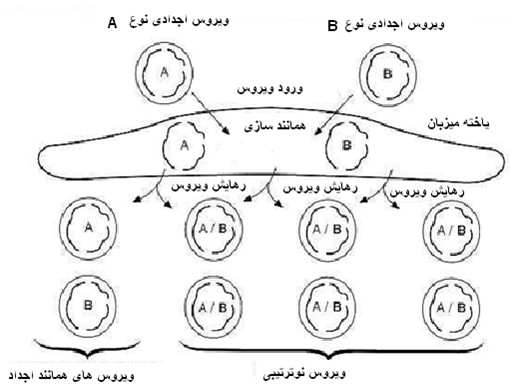
روند نوترتیبی
قابلیت زیستی ویروس محدود است بطوری که این ویروس بصورت ذره معلق در دمای 25 درجه سانتی گراد بیش از یک ساعت فعال می ماند همچنین ویروس قادر است در محیط های قلیائی یا خنثی ، مخلوط با سرم یا دیگر پروتئین ها وقتی که دمای محیط 4 درجه سانتی گراد است تا 4 ماه و درصورتی که دمای محیط زیر صفر درجه سانتی گراد است تا 8 سال فعال مانده ؛ ویروس به PH پائین (اسیدی مانند اسید استیک ، کمتر از 2/6) ، حلال های چربی و مواد پاک کننده ، اتر ،کلروفرم و محلول های هیپوکلریت سدیم یا کلسیم توام با باقی مانده کلرین بیش از 5000 قسمت در میلیون بسیار حساس است ؛ تغییر اسیدیته گوشت مدت کوتاهی پس از کشتار به منظور نابودی ویروس کافی است و همچنین پاستوریزه کردن شیر ویروس را ازبین می برد.
|
اثرات دما |
در دمای 4 درجه سانتی گراد چند ماه دوام دارد. در سرم و تحت دمای 56 درجه سانتی گراد ودر طی 120 دقیقه غیر فعال می شود . |
|
اثرات PH |
در محیط قلیائی مقاوم بوده ولی در محیط اسیدی با PH کمتر از 2/6 غیر فعال می شود. |
|
اثرات مواد شیمیائی |
تحت اثر اتر و کلرفرم غیر فعال می شود. |
|
اثرات مواد ضدعفونی کننده |
توسط محلول های قوی هیپوکلریت سدیم یا کلسیم غیر فعال می شود .(باقی مانده های کلرینه بایستی بیش از 5000 قسمت در میلیون باشد ). |
|
توانائی زیستی |
در ترشحات خشک شده زنده مانده و در برخی از بند پایان حامل تکثیر می یابد .در صورت تماس با فنل 5/0درصد در دمای 4درجه سانتی گراد تا 6 ماه دوام دارد . |
توانائی زیستی در تحت شرایط فیزیک و شیمی
همه گیر شناسی :
بیماری تب دره ریفت یک ناخوشی حاد ، تب زای قابل انتقال توسط بند پایان بوده(بند پا بر[7]) که در این امرپشه ها نقش اصلی را دارند و شواهدی مبنی بر اینکه بیماری با شیوه تماس مستقیم مابین دامهای حساس انتقال یابد موجود نیست. پشه های خون خوار مختلفی می توانند در انتقال بیماری ایفای نقش نمایند، پشه آدس[8]، آنوفل[9] ، کولکس [10]، اریتماپودیت[11]، مانسونی[12] و انواعی دیگر قادرند که بعنوان یک حامل صلاحیت دار زیستی عامل بیماری را منتقل کنند . پشه آدس علاوه بر اینکه نقش حامل زیستی را دارد بعنوان یک میزبان مخزن [13] نیز عمل می کند . چون حامل اولیه پشه می باشد همه گیری های این بیماری اساساً بدنبال بارندگی های شدید توام با طغیان آب پدیدار می گردد . تخم پشه ها بطور طبیعی به ویروس بیماری آلوده بوده و در نتیجه پشه های نسل بعدی نیز قاردند ویروس را به هنگام گزش میزبان های حساس به آنها منتقل نمایند (تخم گذر) . بررسی ها نشان داده که تخم های نهفته پشه ها برای سالها حاوی ویروس بیماری است ، در طی دوره های بارندگی شدید این تخم ها تفریخ شده و پشه های حاصله آلوده هستند که متعاقباً سبب اشاعه بیماری می شوند . در میان پشه ها نوع آدس نقش اصلی را در ذخیره و حمل عامل بیماری برای نسل های بعدی دارد . ویروس بیماری قادر است توسط حاملین دیگری همچون بسیاری از پشه ها و احتمالاً دیگر حشرات گزنده چون کنه و پشه های ریزمانند پشه خاکی منتقل شود ، این گونه ها پس از گزش دام مبتلا و تغذیه خون آنها آلوده شده وبیشتر در انتشار بیماری ایفای نقش می کنند. درواقع پشه های(آدس) آلوده حاصل از تفریخ تخم های آلوده میزبان های افزاینده [14] را آلوده کرده و متعاقباً این نوع میزبان ها نیز بعنوان منبع عفونت برای دیگر پشه های حامل عمل می کنند ، در نتیجه بیماری به سرعت منتشر می گردد. ازطرفی ویروس می تواند بصورت داخل رحمی در گاو وگوسفند به جنین منتقل گردد . همچنین ویروس در مایع منی و شیر خام نیز حضور دارد .
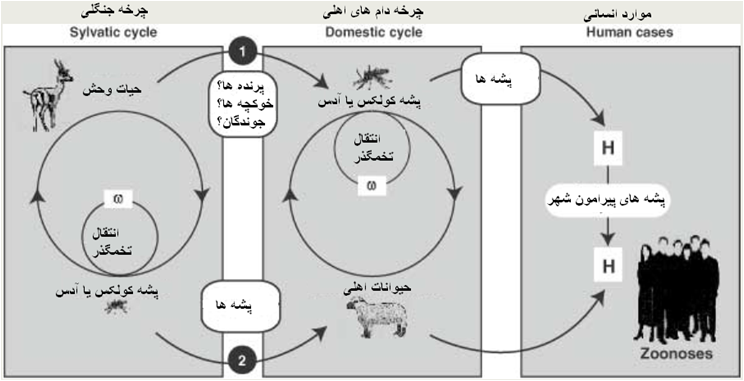
تا کنون به نظر می آید که بیماری درآفریقا و شبه جزیره عربستان محدود شده . آگاهی از چرخه ویروس درپشه آلوده بطور اساسی درک ما را نسبت به صلاحیت دار بودن پشه در انتقال بیماری افزایش می دهد . زمانی که یک پشه صلاحیت دار از خون مهره دار آلوده ای تغذیه می کند ،ویروس وارد یاخته های پوششی روده میانی (midgut) شده وهمانند سازی می کند، پس از این تکثیر ویروس های حاصله به دیگر بافت های پشه همچون غد بزاقی و یا تخمدان ها پراکنده می شوند . بدین طریق ویروس بطور افقی از طریق بزاق پشه آلوده در هنگام گزش به میزبان های حساس دیگر منتقل شده و یا بصورت عمودی (تخم گذر) به نسل بعدی پشه های انتقال یافته ومتعاقباً میزبان مهره دار دیگری را مبتلا می سازد . تمامی پشه هائی که از میزبانهای آلوده تغذیه کرده اند دچار عفونت نشده و یا اگر شدند آن را انتقال نمی دهند . سد های متعدد در مقابل عبور ویروس و انتقال نهائی آن در پشه های غیر صلاحیت دار یا نسبتاً صلاحیت دار معین گردیده که عبارتند از سد های گریزروده ای و سد های عفونی غدد بزاقی .غشای پایه خارج یاخته ای پیرامون بافت پوششی روده میانی و غشای پایه محاط بر غدد بزاقی ممکن است بعنوان یک چنین سد عبوری عمل نماید . ابعاد منافذ غشای پایه روده میانی بطور معنی داری از آربو ویروس ها(ویروسهائی که توسط بند پایان منتقل می شوند)کوچک تربوده و شواهد متعدد دیگر نیز این گمان را مطرح می سازد که نایژه و نایژک های روده میانی ممکن است راهی را برای گریز ویروس از این سد فراهم سازند . علاوه بر این شواهد ایمنی شیمیایی یاخته ای [15] نشانگر حضور یک سد عفونی غده بزاقی در پشه آنوفل (Anopheles stephensi) است . غشای پایه ممکن است امکان دسترسی ویروس به گیرنده های ویروسی سطح یاخته های پشه را منتفی سازد ، این موضوع به تفهیم این امر که چرا پشه های آنوفلین درمقام مقایسه با پشه های کولیسین جهت انتقال آربوویروس ها نسبتاً غیر صلاحیت دار هستند کمک می نماید . منابع ویروس برای دامها شامل حیوانات وحش و حاملین بیماری است و در خصوص انسان این منابع عبارتند از ؛ ترشحات بینی ، خون ، ترشحات مهبلی پس از سقط در حیوانات ، پشه ها و گوشت آلوده ، احتمال این مورد نیز وجود دارد که ذرات معلق و مصرف شیر خام برای انسان مسئله ساز باشد . همه گیری های این بیماری بصورت دوره ای و فاصله دار است ، زمانی که بارندگی های شدید موجب تفریخ تخم های آلوده نهفته می شود و جمعیت حساس دامی نیز نیز در منطقه حضور دارد می توان شاهد بروزیک همه گیری بود که سبب بروز تلفات زیادی درنوزادان و حیوانات جوان شده و میزان سقط جنین در گله های درگیر نیز بالا است . گاوهای بومی در منطقه ممکن است تظاهرات بالینی را نشان دهند ولی شدت بیماری بیشتر در نژادهای غیر بومی تظاهر می نماید . سن عامل مهمی در حساسیت حیوانات نسبت به بیماری است ، نرخ تلافات در حیوانات جوان شامل نوزاد نشخوارکنندگان ، توله سگ ها و بچه گربه ها بالا است که با افزایش سن از میزات تلفات کاسته می شود . میزان تلفات در بره های تازه متولد شده 90 تا 100 درصد است ، در حالی که این میزان برای گوسفندان بالغ در همه گیری های متفاوت و مزارع مختلف از 5 تا 100 درصد متغیر می باشد .بیشترین میزان مرگ و میر در میان میش های سقط کرده دیده می شود. تخمین میزان تلفات در گوساله ها از 10 تا 70 درصد متغییر می باشد اما در گاوهای بالغ کمتر از 10 درصد موارد عفونی منجر به مرگ می شوند . میزان سقط جنین در میش ها از 5 تا تقریباً 100 درصد متغییر است . همه گیر های این بیماری در آغاز ممکن است بصورت موج گسترده ای از سقط جنین های مبهم در گله درگیر باشد. اگرچه تا 85 درصد گاوهای آبستن در برخی از همه گیری ها دچار سقط می شوند ولی نرخ سقط جنین در این گونه دامی عموماً کمتر از 10 درصد است . میزان سقط در شتر می تواند بیشتر از گاو باشد .انسان بعنوان یک میزبان اتفاقی مطرح بوده که در طی همه گیر های دامی از طریق گزش پشه های آلوده ویا از طریق تماس با بافت های آلوده حیوانی در طی زایمان ، کالبد گشائی ، کشتار ، انجام مراحل آزمایشگاهی یا فرآوری گوشت های آلوده مبتلا می شود. در انسان ویروس ممکن است از طریق تلقیح (اگر پوست خراش داشته باشد) یا بصورت استنشاق ذرات معلق آلوده منتقل گردد ولی به نظر نمی رسد که تماس معمول با دام های آلود سبب انتقال بیماری شود. انتقال داخل رحمی به جنین برای اولین بار در سال 2006 در انسان گزارش گردیده . بیماری برای انسان بشدت مسری است و موجب یک انتشار ویروسی خونی (ویرمی ) می گردد . این وضعیت انتشار خونی به حدی مناسب است که امکان آلودگی پشه ها گزنده از افراد بیمار را محقق می نماید . لذا افراد بیمار قادرند بعنوان منبع عفونت برای پشه ها ویروس را به مناطق عاری از بیماری منتقل نمایند .چوپان ها ، گله داران ، کارگران کشتارگاه ، دامپزشکان و کارگران قصابی بیشتر از دیگر افراد در معرض ابتلای به بیماری هستند. سفرهای بین المللی در صورتی که منجر به انتقال پشه ها و دیگر حشرات گزنده گردد خطر انتشار بیماری را فراهم می آورند . بیماری قادر است در بسیاری از گونه های حیوانی موجب بروز بیماری گردد که عبارتند از گوسفند ، گاو ، بز ، گاومیش ، شتر ، میمون ، سنجاب خاکستری و دیگر جوندگان . گوسفند و گاو بعنوان میزبان های افزایند بوده و در آغاز همه گیری ها عمدتاً این گونه های درگیر می شوند . انتشار خونی ویروس را بدون بروز نشانهای بیماری می توان درگربه های بالغ ، سگ ها ، اسب ها و برخی از میمونها دید ، ولی بیماری بصورت شدید در توله سگ های تازه متولد شده و بچه گربه ها پدیدار می گردد . انتشار خونی ویروس در خرگوش ، خوک ، خوکچه هندی ، جوجه ها و جوجه تیغی بوجود نمی آید .
|
انتشار خونی خفیف بدون بروز عفونت |
انتشار خونی ویروس ، سقط جنین عفونی |
سقط جنین با تلفات و بیماری شدید |
تلفات 100درصد گله بوده با برروز بیماری بصورت شدید |
|
خوگچه هندی خرگوش خوک جوجه تیغی لاک پشت قورباغه جوجه قناری کبوتر طوطی |
اسب گربه سگ میمون |
میمون شتر خوکچه سنجاب خاکستری |
بره ها گوساله ها بزغاله ها توله سگ ها بچه گربه ها موش سفید هامستر موش صحرائی موش خانگی گوسفند گاو بز گاومیش آبی انسان |
گستره میزبانی و شدت بیماری
روند بیماری زائی:
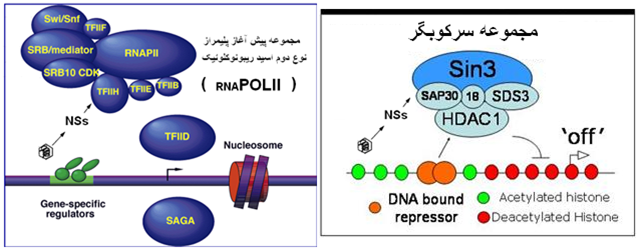
ویروس عامل بیماری تب دره ریف از دسته ویروس هایی است که اثر کشندگی بر یاخته آلوده دارند [16]. این ویروس سبب تشکیل پلاک شده ، تکثیر آن تیتر بالایی از ویروس را تولید نموده و تمایل تهاجم به کبد (نکروز کانونی)[17] و مغز (التهاب مغزی نکروز شونده)[18] را دارد . با گزش دام حساس توسط پشه آلوده ویروس از طریق بزاق آلوده وارد پوست در ناحیه نیش زده می گردد ، ویروس بواسطه جریان لنفاوی خود را به غدد لنفاوی منطقه رسانده و اولین مرحله تکثیر ویروسی دریاخته های لنفاوی را سپری می نماید. ویروس های تکثیر یافته پس از رهایش از طریق مجاری وابران لنفی به گردش خون عمومی رسیده و موجب آلایش خونی (ویرمی) می گردند. ویروس ها توسط جریان خونی به تمای بخش های بدن رسیده و عمدتاً در کبد و طحال شروع به تکثیرثانویه می نمایند. همچنین ممکن است که ویروس از سد خونی مغزی نیز عبور کرده و موجب بروز عفونت در یاخته های عصبی و یاخته های پشتیبان (گلیال ) گردد . التهاب توام مغز و پرده های مغزی[19] و همچنین التهاب شبکیه [20] از پی آمد های این بیماری است که 2 تا 3 هفته پس از شروع عفونت و با یک التهاب شدید تظاهر می نماید. به نظر می رسد که عفونت ناشی از این ویروس توسط اینترفرون های تولید شده(آلفا، بتا و گاما) توسط لوکوسیت ها و فیبروبلاست ها ی سامانه ایمنی بدن کنترل شده و بواسطه تولید پادتن های خاص توسط لنفوسیت های تخصص یافته خاتمه می یابد . واکنش مرگ یاخته ای ناشی از تکثیر ویروس که خاص این نوع ویروس است اساساً با برانگیختن روند نکروز یاخته ای محقق می گردد . در پریمات ها الگوی این ویروس ایجاد انعقاد داخل رگی منتشره است . از این رو ویروس فوق موجب بروز تب خونریزی دهنده کشنده[21] در انسان شده و از طرفی در نشخوار کنندگان با گرایش به هپاتوسیت ها سبب بروز التهاب کبدی می گردد . برسی های بعمل آمده در یاخته های آلوده به این ویروس نشان می دهد که روند تولید اسید ریبونوکلوئیک (mRNA) به موازات کاهش میزان عامل رونوشت برداری یاخته ای (TFIIH) و در نتیجه غیر فعال شدن مجموعه پیش آغاز RNAپلیمراز نوع دوم [22] (POLII) سرکوب می گردد. اساساً TFIIH یکی ازاجزای پروتئینی سازنده پلیمراز 2 می باشد . سا زو کار این رخداد با تاثیر پروتئین غیر ساختاری NSs ویروس بر روی TFIIH آغاز می گردد. این پروتئین غیر ساختاری ویروس (NSs) با یکی از اجزای پروتئینی TFIIH بنام p44 واکنش داشته بطوری که موجب تشکیل ساختار های ریز رشته ای (تارچکی)[23] در هسته یاخته آلوده می گردد. این تارچک های پدیدار شده جزء دیگری از TFIIH را نیز در بر می گیرند که XPB نامیده می شود . نتیجه این رخدادها دور ماندن XPB و p44 از TFIIH و نزدیک شدن رقیب p44 بنام XPD به TFIIHاست، از این رو یکپارچگی و گردآیش اجزای TFIIH ممکن نشده و روند رونوشت برداری از ژنوم یاخته توسط مجموعه پیش آغاز RNAپلیمراز نوع دوم که در حال عادی به تولید mRNA ختم می شد محقق نمی گردد یعنی به عبارتی روند بیان ژن متوقف می شود . نتیجه این توقف روند بیان ژنی ( عدم تولید mRNA) عدم تشکیل پروتئین های است که با تاثیر اینتر فرون ها (آلفا و بتا) بر یاخته های آلوده به ویروس بایستی ایجاد می شدند . در نتیجه ویروس با غیر فعال سازی روند بیان ژنی اثر ضد اینترفرونی اعمال کرده وروند ممانعت از تکثیر ویروسی را خنثی می سازد . بنابر این پروتئین غیر ساختاری NSs عامل حدت در ویروس این بیماری است . بعنوان مثال در یکی از سویه های ویروس بنام کلون 13 که در مقایسه با سویه ZH548 تخفیت حدت یافته است ، پروتئین NSs آن در نتیجه تغییر جزئی در توالی ژنی ناقص شده . همچنین درنتیجه واکنش بین NSs و SAP30 (جزئی از مجموعه سرکوبگر) ژن پیشبرنده اینترفرون بتا در یک حالت سرکوب شده باقی مانده و در نتیجه یاخته از ایجاد پاسخ های ضد ویروسی باز می ماند . مجموعه این تاثیرات ویروسی بر یاخته آلوده شرایط را برای بقاء و ادامه روند تکثیر فراهم ساخته تا درنتیجه این تکثیر و رهایش ویروس بیماری در بدن گسترش یابد . بسته به وضعیت سامانه ایمنی بدن و وجود یا عدم وجود پادتن های ضد ویروسی میزان تلفات در دام متفاوت خواهد بود . ولی نهایاً با تولید پادتن های ضد ویروسی تولید شده توسط لنفوسیت های حساس شده ویروس از ادامه روند گسترش باز مانده و بیماری متوقف می گردد .
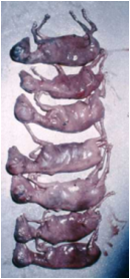
نشانه های بالینی:
دوره نهفته بیماری در گوسفند ، بز و سگ می تواند تا 3 روز تداوم داشته باشد .در بره ها تازه بدنیا آمده این دوره 12 تا 36 ساعت می باشد ، ولی با ایجاد عفونت های تجربی در بره ها ، گوساله ها ، بزغاله ها و توله ها علائم معمولاً پس از 12 ساعت بروز می نماید . نشانه های بالینی بسته به سن دام متغییر است . در مناطقی که بیماری بومی شده بروز همه گیری ها بصورت تلفات شدید نوزادان و سقط در بالغین است . معمولاً بیماری در حیوانات جوان شدید تر بوده و میزان تلفات ممکن است به 90 تا 100 برسد . در بره ها تب دو مرحله ای ، بی اشتهائی و آسیب های غدد لنفاوی [24] ممکن است با سستی و مرگ در طی 36 ساعت بدنبال بروز عدم تعادل و زمین گیری تظاهر نماید .


اسهال خونی یا درد شکمی را نیز می توان مشاهده کرد . در گوساله های جوان تظاهرات مشابهی را می توان دید . تب ، بی اشتهائی و افسردگی از معمول ترین نشانه های بالینی بوده و میزان تلفات به 10 تا 70 درصد می رسد . سقط جنین از شاخص ترین نشانه ها در گوسفندان و گاوهای بالغ مبتلا می باشد اما تلفات ممکن است در گوسفندان به 20 تا 30 درصد و در گاوها تا 10 درصد برسد ، معمولاً در موارد منجر به مرگ 1 تا 2 روز پیش از تلف شدن دام تب در اوج خود می باشد .

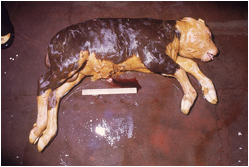
از دیگر علائمی که در گوسفندان بالغ قابل مشاهده است می توان به تب(40-41 درجه سانتی گراد) ، سستی ، ترشحات مخاطی چرکی بینی (گاهی خون رنگ) ، وجود ملانا ، اسهال خونی یا بد بو و استفراغ اشاره نمود.
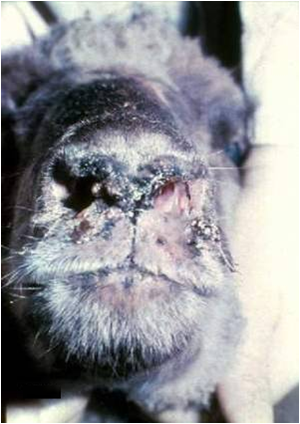

در گاوهای بالغ تب ، بی اشتهائی ، سستی ، افزایش تراوش بزاق ، اسهال بد بو و کاهش تولید شیر گزارش گردیده . تظاهر به زردی را نیز خصوصاً در گاو می توان دید . در بز عفونت مشابه ولی ملایم تری را می توان یافت و تنها نشانه بروز یک واکنش تب است . در شتر بالغ بغیر از سقط جنین نشانه دیگری را نمی توان یافت ، اما در جوان ترها بیماری ممکن است شدید تر تظاهر نماید . در گربه ها بالغ ، سگ ها ، اسب ها و برخی از میمون ها ممکن است عفونت خونی منتشره بدون نشانه شدیدی از بیماری دیده شود ولی در توله های و بچه گربه های تازه بدنیا آمده بیماری حاد تر می باشد .
|
تظاهرات بالینی در بیماری تب دره ریفت | |
|
گاو | |
|
نوع شاخص بالینی |
چهره بالینی |
|
دوره نهفته |
1 تا 6 روز |
|
نشانه های بالینی |
گوساله ها: |
|
موارد پیشرفته و بغرنج |
—سقط جنین تا 85 درصد گله با جنین های غالباً لیز شونده |
|
میزان تلفات |
—در گوساله ها 10 تا70 درصد و در بالغین کمتر از 10 درصد |
|
گوسفند و بز | |
|
دوره نهفته بیماری |
بره ها 12 تا 36 ساعت |
|
نشانه های بالینی |
بره ها: |
|
موارد پیشرفته و بغرنج |
—میزان سقط جنین تا 100 نیز میرسد جنین های غالباً لیز شونده هستند |
|
میزان تلفات |
بره ها: |
تشخیص آزمایشگاهی:
بیماری تب دره ریفت را می توان به لحاظ آزمایشگاهی با جداسازی ویروس عامل بیماری از خون دام تب دار تشخیص قطعی داد . در میزبان های زنده معمولاً انتشار خونی ویروس در طی 3 روز ابتدای تب قابل ردیابی است . همچنین می توان ویروس را از بافت های دام های تلف شده و جنین های سقط شده جدا نمود؛ بدین منظور می توان از کبد ، طحال و مغز بطور عمومی استفاده کرد . ویروس را می توان در محیط های کشت یاخته ای مختلفی شامل : یاخته های کلیه بچه هامستر(BHK) ، یاخته های کلیوی میمون سبز آفریقائی (Vero) ، رتیکولوم جنین مرغ و کشت های اولیه از گاو و گوسفند ، رویاند . به این منظور از هامستر، موش بالغ یا شیر ی ، تخم مرغ جنین دار یا بره های دو روزه نیز استفاده کرد . تیتر ویروس در بافت ها غالباً زیاد بوده و تشخیص سریع با استفاده از آزمون های ثبوت مکمل ، خنثی سازی ، انتشار در آگار ژل دار برروی سوسپانسیونهای بافتی امکان پذیر است . همچنین می توان پادگن های ویروسی و RNA ویروس را در خون و نمونه های بافتی با استفاده از آزمون های تعین پادگنی و واکنش پلیمراز زنجیری – رونوشت برداری معکوس (RT-PCR) ارزیابی نمود. با بکارگیری شیوه رنگ آمیزی درخشندگی ایمنی (پادتن های درخشان) بر روی فروتی های بدست آمده از کبد، طحال یا مغز می توان حضور پادگن ویروسی را تعین نمود .وجود ویروس در خون را می توان با استفاده از آزمون های ارزیابی ایمنی آنزیمی[25] و انتشار ایمنی[26] تائید کرد . آزمون واکنش زنجیره ای پلیمراز –رونوشت برداری معکوس (RT-PCR) می تواند RNA ویروسی را معین سازد . همچنین از آزمون های سرم شناسی عمومی مانند خنثی سازی ویروسی ، الیزا و آزمون مهار ترسیب خونی [27] نیزمی توان استفاده کرد . آزمون های درخشندگی ایمنی، ثبوت مکمل ، ارزیابی ایمنی رادیواکتیوی[28] و انتشار ایمنی کمتر بکار می روند . واکنش های متقاطع با دیگر فلبوویروسها در آزمون های سرم شناسی بغیر از آزمون خنثی سازی مقدور است . در روش های سرم شناختی چون الیزا (ارزیابی ایمنی اتصال آنزیمی) و ارزیابی ایمنی آنزیمی حضور پادتن های خاصی(IgM) و ازدیاد تیتر آنان مورد تائید قرار می گیرد که این ارزیابی در مرحله حاد بیماری محقق می گردد. خود ویروس را می توان در طی مرحله اولیه بیماری در خون و یا در بافت های دام تلف شده با استفاده از شیوه های فراهم سازی ویروسی ( در محیط کشت یاخته ای یا حیوانات تحت تلقیح ) ، آزمون های تعین پادگنی و واکنش زنجیره ای پلیمراز – رونوشت برداری معکوس تشخیص داد .
به لحاظ آسیب شناسی تغییرات ریزبینی قابل مشاهده در بره ها و گوسفندان بالغ مشابه می باشد . در طی مراحل اولیه بیماری تغییرات بافت کبدی از نظر توزیع ضایعه بصورت ناحیه ای است . مجموعه ای از نوتوفیل های تجمع یافته در سینوسوئید های کبدی را می توان دید . سپس گروهی از یاخته های کبدی نکروزه در نزدیکی یاخته های سفید خونی تجمع یافته ظاهر می شوند . معهذا بعداً کانون های نکروزه با هم در آمیخته تا اینکه تقریباً تمامی یاخته های کبدی موجود در یک قطعچه (لوبول) و حتی تمای اندام نکروزه می شود . طول زمان پایداری وقابلیت زیستی یاخته های پیرامون قطعچه ها در مقایسه با یاخته های دیگر لایه های قطعچه ای بیشتر است . طیف گسترده ای از تغییرات ازمحلالی و نکروزه در یاخته های کبدی را می توان مشاهده نمود . برجسته ترین این تغییرات شامل دگرگونی های آشکار هسته ای (خوشه ای و حاشیه گزینی کروماتین، چروکیده شدن هسته و متراکم شدن کروماتین [29]، پاره شدن هسته بطوری که کروماتین به اشکال دانه ای خرد می شود[30] ) ،ازمحلال و جداشدگی [31]سیتوپلاسمی وتشکیل اجسام سیتوپلاسمی اسید دوست (شبه گنجیدگی) . در انسان نیز آسیب های کبدی گسترده مشابهی ظاهر می گردد .
پیش از اقدام به نمونه گیری یا ارسال نمونه از دامهای مشکوک به بیماری بایستی سازمان دامپزشکی را از این امر مطلع ساخت . نمونه ها بایستی به آزمایشگاه مرجع ارسال شده و کلیه اقدامات حفاظتی در خصوص ارسال نمونه ها به منظور ممانعت از اشاعه بیماری بعمل آید . نمونه های مناسب به منظور ارزیابی پادتنی از دام زنده شامل خون هپارینه یا لخته شده و سرم یا پلاسما می باشد، برداشت نمونه خونی دوم 30 روز پس از اولین نمونه گیری بایستی صورت گیرد . در بررسی ها آسیب شناسی از کبد ، طحال ، کلیه ، غدد لنفاوی و خون قلبی نمونه برداری می شود ؛ بافت های مغزی جنین سقط شده نیز ممکن است مورد آزمایش قرار گیرد . نمونه ها بایستی در مجاورت یخ بصورت فشرده و برجسب دار ارسال گردند . وقتی امکان ارسال سریع نمونه ها وجود نداشته باشد دو دست نمونه بایستی فرستاده شود ، یکی در محلول نمکی یا گلیسرول و دیگری در فرمالین 10٪.
|
تعین عامل بیماری |
|
جدا سازی ویروس: - تلقیح به موش یا هامستر(روش ترجیحی) - تلقیح به بره های 1 تا 2 روزه - تلقیح به تخم مرغ جنین دار - تلقیح به محیط کشت بافتی(Vero, CER, BHK-21, ، یاخته های دودمانی پشه یا یاخته های اولیه کلیوی وبیضه گوساله ، بره و بز) توام با درخشندگی ایمنی. تعین پادگن ویروسی : با استفاده از درخشندگی ایمنی (immunofluorescence) در برش های انجمادی یا فروتی های تهیه شده از کبد ، طحال و مغز . همچنین بااستفاده ازآزمون ثبوت مکمل و انتشار ایمنی در سوسپانسیون های بافتی . تعین پادگن در خون: با استفاده از آزمون های انتشارایمنی(immunodiffusion) وارزیابی ایمنی آنزیمی (enzyme immunoassay). |
|
آزمون های سرم شناسی |
|
آزمون جاذب ایمنی متصل به آنزیم-IgG و IgM Enyzme-linked immunosorbent assay خنثی سازی ویروس Virus neutralization آزمون پادتن های درخشان Fluorescent antibody test آزمون مهار ترسیب خونی Haemagglutination inhibition آزمون ثبوت مکمل Complement fixation آزمون انتشارایمنی Immunodiffusion خنثی سازی احیای پلاکی Plaque reduction neutralisation |
خلاصه ای از روش های تشخیص
یافته های کالبد گشائی:
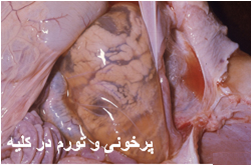
اولین نکته در ارزیابی های کالبد گشایی بیش از همه رعایت اصول حفاظتی و مراقبتی در انجام کالبد گشایی است که به جهت مشترک بودن بیماری ، فرد عامل بایستی دقت کافی را مبذول نماید . پایدارترین ضایعه شاخص مرضی در این بیماری نکروز کبدی بوده که بصورت کانون های نکروزه زرد تا خاکستری رنگ متعدد در ابعادی حدود یک میلیمترو محصور درنوار قرمز پرخونی در پارانشیم کبدی تظاهر می نمایند ، درحیوانات جوان این کانون ها گسترده تر و شدیدتر می باشد. همچنین کبد پرخون ، متورم و رنگ باخته است و همراه آن خون ریزی های زیر کپسولی دیده می شود، در میش های بالغ تغییرات کبدی مشابه بره ها بوده ولی از شدت کمتر برخوردار است و غالب ترین تظاهر وضعیت خال خالی در کبد است .
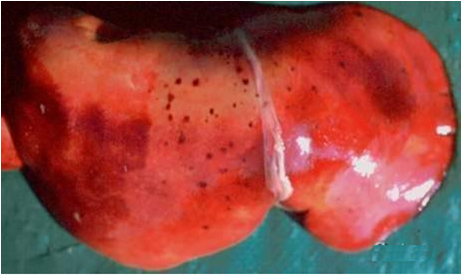
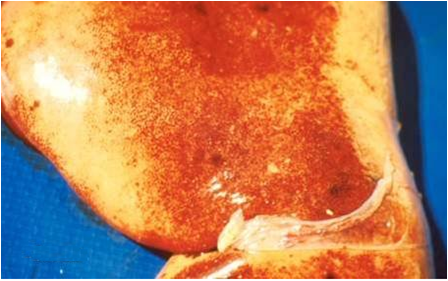
در جنین های سقط شده و بره های نوزاد ، کبد ممکن است خیلی بزرگ ، قهوه ای مایل به زرد تا قهوه ای مایل به قرمزسیر، نرم و ترد ، با تکه های نامنظمی از پرخونی باشد . معمولاً کانون های نکروزه سفید تا خاکستری رنگ بر روی کبد مشهود است اما این کانون ها ممکن است تنها بصورت ریزبینی قابل مشاهده باشند . معمولاً ضایعات کبدی در حیوانات بالغ شدت کمتری داشته و ممکن است مشتمل بر کانون های نکروزه سرسوزنی شکل سرخ رنگ تا سفید خاکستری باشند .
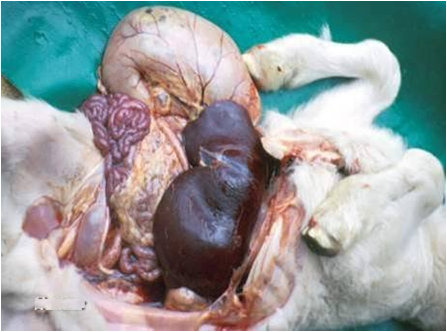
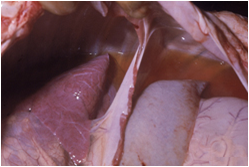
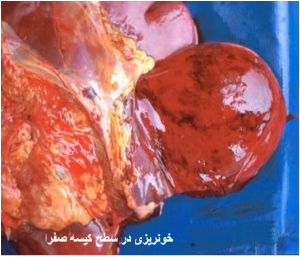
در موارد پیشرفته تمامی کبد هم در سطح کپسولی و هم در سطح برش زرد مایل به خاکستری است . کانون جدیدی از خون ریزی در طول کپسول نیز ممکن است قابل تشخیص باشد . دیگر نوع ضایعات نیز ممکن است بروز نماید که عبارتند از : زردی(به نسبت کم) ، خونریزی های پوستی منتشره و تجمع مایعات در حفرات بدن . غدد لنفاوی و طحال بطور نمادین متورم و آماسی بوده و غالباً دارای خونریزی های سرسوزنی هستند . دیواره کیسه صفرا در غالب موارد آماسی بوده و همراه آن خونریزیهای دیده می شود . کلیه ها پرخون بوده ودارای خونریزی های قشری هستند . گاهی بدرجات متنوع در روده ها التهاب یا التهاب روده ای خونریزی دهنده را می توان دید .
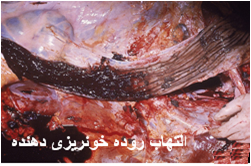
در بره ها خونریزی های کوچک بی شماری بطور نمادین در مخاط شیردانی پدیدار هستند وروده کوچک و شیردان ممکن است دارای محتویات قهوه ای – شکلاتی تیره توام با خون نسبتاً هضم شده باشد .
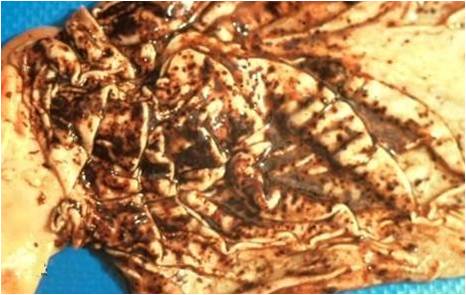
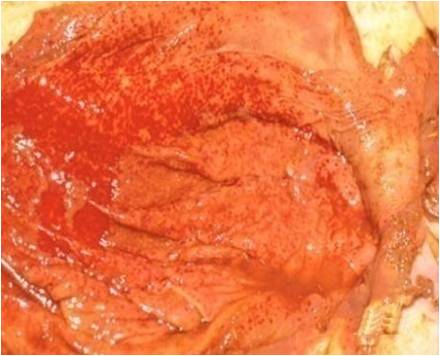
علاوه براین خون ریزی های سرسوزنی(پتشی) و کشمشی(اکیموز) نیز ممکن است در سطوح دیگر اندام های احشائی بدن مشاهده شود. به لحاظ ریزبینی نکروز کبدی از غالب ترین ضایعات قابل مشاهده است .
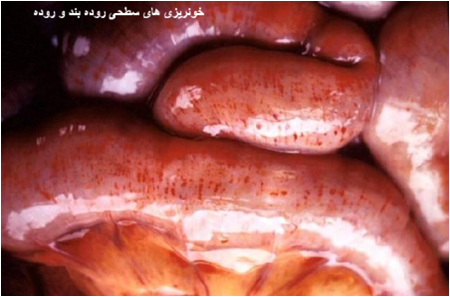
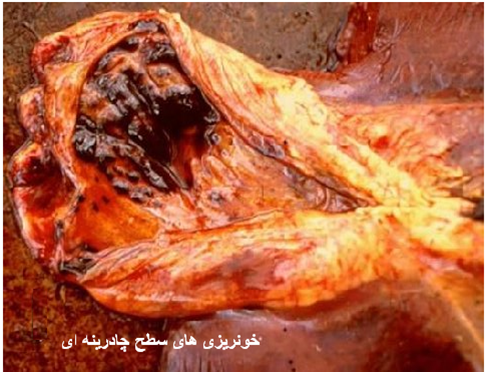
|
بره های نوزاد و جنین های سقط شده |
|
- شاخص ترین چهره کالبد گشائی شامل ضایعات کبدی شدید و کبد بزرگی است که ترد ، نرم و قرمز تا قهوه ای مایل به زرد است و در آن خونریزی های سر سوزنی مشهود می باشد . نواحی از پلاک های پرخون و کانون های خاکستری کوچکی ممکن است بطور پراکنده در طول پارانشیم کبدی دیده شوند . نکروز شدید بوده و بواسطه تجمع فشرده پس مانده های یاخته ای و هسته ای و همچنین بواسطه حضور فیبرین ویاخته های التهابی مشخص می شود . همچنین انجام کالبد گشائی اجسام گنجیدگی داخل یاخته ای ائوزینوفیل و میله ای شکلی را تقریباً در نیمی از نمونه های کبدی مورد ارزیابی آشکار می نماید . - محتویات شیردان و روده کوچک بره های نوزاد به رنگ قهوه ای شکلاتی است . |
|
گوسفندان بالغ |
|
ضایعات کبدی در مقایسه با بره ها و جنین های سقط شده از شدت کمتری برخوداربوده اما زردی عمومیت دارد . |
|
گوساله ها و گاو های بالغ |
|
ضایعات کبدی در مقایسه با گوسفند شدت کمتری داشته و کبد دارای کانون های نکروزه قابل روئیت و لوبلاسیون مجزا است . |
|
در غالب حیوانات |
|
- آماس و خونریزی در دیواره کیسه صفراوی . - تورم غدد لنفاوی محیطی و احشائی. - خونریزی های زیر جلدی و سروزی گسترده از اندازه سرسوزن تا کشمشی . - تجمع مایعات خون رنگ در حفرات بدن . - التهاب روده ای خونریزی دهنده و خونریزی های گسترده زیر جلدی . |
خلاصه کالبد گشائی
تشخیص تفریقی:
بیماری تب دره ریفت را می توان با شماری از دیگر بیماری ها که شاخص مرضی آنان ضایعات کبدی است اشتباه نمود . محدودیت فصلی بروز این بیماری ممکن است آن را با بیماری زبان آبی در گوسفند و تب سه روزه در گاو مشتبه نماید و ظرفیت بالای ایجاد تلفات ناشی ازآن در بره ها ممکن است به تشخیص عجولانه آنتروتوکسمی بیانجامد. در حیوانات بالغ دیگرعوامل سقط جنین شامل عفونت های ناشی ازبیماری ویسلبورن و دیگر فلاویروس ها که موجب سقط و مرگ نوزادن همراه با ناهنجاری های مغزی در گوسفند می شوند لزوماًبایستی درتشخیص تفریقی مورد توجه قرار گیرند . تشخیص مقدماتی [32] مبتنی بر نشانه های بالینی ، ارزیابی های همه گیرشناسی و مشاهدات کالبد گشائی است اما تشخیص قطعی [33] لزوماً متکی بر یافته های آزمایشگاهی است .
|
وضعیت ها و عواملی که در تشخیص تفریقی بایستی مورد توجه واقع شوند . | |
|
- عفونت خونی منتشره باکتریائی. - دریافت سموم گیاهی. - ویروس طاعون گاوی. - طاعون نشخوارکنندگان کوچک. - بیماری نایروبیائی گوسفند. - زبان آبی. - بیماری وسلزبورن. - تب سه روزه. - آنتروتوکسمی . - تب مالت(بروسلوز). - ویبریوز. - تریکومنیازیس - بیماری قلب آب آورده - سقط جنین همه گیر گوسفندی |
Bacterial septicemias Consumption of plant toxins Consumption of plant toxins Peste des petits ruminants Nairobi sheep disease Bluetongue Wesselsbron disease Bovine ephemeral fever Enterotoxemia of sheep Brucellosis Vibriosis Trichomoniasis Heartwater disease Ovine enzootic abortion |
خلاصه ای از موارد تفریقی
جنبه های بهداشت عمومی:
در طی همه گیری های دامی آلودگی به انسان نیز منتقل شده و موجب بروز همه گیری های انسانی می گردد . انسان از راه ها و سازوکارهای مختلفی به بیماری مبتلا می شود . این راه ها عبارتند از:
- گزش توسط پشه آلوده(حامل) .
- تماس مستقیم با بافت های دام مبتلا و ذرات معلق تولید شده در مراحل کشتار دام .
- ذرات معلق بوجود آمده طی مراحل آزمایشی در آزمایشگاه .
بیشتر موارد آلودگی انسانی ناشی از تماس مستقیم یا غیر مستقیم با خون یا اندام های حیوانات آلوده می باشد . ویروس قادر است از طریق دستکاری بافت های حیوانی در طی کشتار یا قصابی یا کمک به زایش دام ، اعمال خدمات دامپزشکی ، یا به هنگام معدوم سازی لاشه های دامی آلوده یا جنین های سقط شده به انسان منتقل گردد. بنابر این گروه های شغلی معینی چون چوپانان ، دامداران ، کشاورزان، کارگران کشتار گاه و دامپزشکان در معرض ابتلای به بیماری هستند . ویروس قادر است انسان را از راه تلقیحی آلوده نماید ، بعنوان مثال در نتیجه زخمی شدن با چاقوی آلوده ، یا از طریق تماس با پوست ترک دار ، یا از طریق استنشاق ذرات معلق ایجاد شده در طی کشتار دامها . شیوه انتقال عامل از طریق ذرات معلق در شرایط محیط آزمایشگاهی نیز امکان پذیر است . شواهدی در دست است که نشان میدهد امکان انتقال آلودگی از طریق خوردن شیر غیر پاستوریزه یا نجوشیده دام مبتلا وجود دارد . همچنین انتقال آلودگی در انسان از طریق گزش پشه آلوده خصوصاً پشه آدس ممکن است . انتقال ویروس توسط حشرات خونخوار نیز امکان پذیر است . در گزارشات هیچ گونه انتقال انسان به انسان وجود ندارد و همچنین درصورت رعایت توصیه های بهداشتی و کنترلی استاندارد هیچ گونه گزارشی از موارد ابتلای کارگران به بیماری وجود ندارد . همچنین هیچ گزارشی از وقوع همه گیری در مناطق شهری وجود ندارد .
درانسان عموماً عفونت تحت بالینی پدیدار شده و علاوه بر آن سه الگوی بالینی از بیماری تظاهر می نماید . در شکل ملایم بیماری دوره نهفته بیماری 2 تا 6 روزاست . این نوع عفونت ممکن است بصورت بی نشان (تحت بالینی) یا بصورت ملایم با مشخصه نشانگان تب و بی قراری توام با شروع ناگهانی تب شبه انفولانزائی ، درد عضلانی ، درد مفصلی و سردرد تظاهر نماید . در برخی از بیماران سفت شدگی گردن ، حساسیت به نور ، بی اشتهائی و استفراغ بوجود می آید ؛ در این افراد ناخوش بیماری در مراحل اولیه آن ممکن است با التهاب پرده های مغزی اشتباه شود . معمولاً این ناخوشی 4 تا 7 روز دوام داشته ، و پس از این مدت پاسخ های ایمنی با ظهور پادتن ها پدیدار شده و ویروس بتدریج از خون حذف می گردد . در حالی که بیشترین موارد ابتلای انسانی نسبتاً ملایم بوده درصد کوچکی از بیماران دچارشکل شدید بیماری می شوند که معمولاً بصورت یک یا بیش از سه نشانگان مجزا تظاهرمی نامید .
1) شکل چشمی(تا 10 درصد موارد ابتلاء ، 1تا3 هفته پس از شروع تب ) : در این شکل از بیماری معمول ترین نشانه های ملازم شکل ملایم این بیماری توام با ضایعات شبکیه است . معمولاً آغاز ضایعه درچشم 1 تا 3 هفته پس از ظهور اولین نشانه ها است . بیماران معمولاً از تیرگی و کاهش بینائی شکایت دارند . بیماری ممکن است به خودی خود و بدون هیچ گونه عارضه ای در طی 10 تا 12 هفته مرتفع گردد. ولی به هر حال زمانی که ضایعه در دیسک بینائی ایجاد شد در 50 درصد موارد بیمار بطور دائمی نابینا می شود . بروزمرگ درافراد مبتلا به شکل چشمی بیماری عمومیت ندارد .
2) شکل التهاب مغزو پرده های مغزی : آغاز التهاب در مغز و پرده های مغزی معمولاً یک تا چهار هفته پس از شروع اولین نشانه های بیماری است . چهره بالینی در این شکل از بیماری شامل سردرد شدید ، فراموشی ، توهم [34] ، گیجی و سردرگمی ، عدم جهت یابی (گم گشتگی)، رعشه ، تلوتلوخوردن، سرگیجه (دوران) ، حملات سرعی ، داءالرقص، رخوت و بی حالی و اغما است . درگیری عصبی می تواند دیرتر ظاهر گردد(بعد از 60 روز). میزان مرگ ومیر در افرادی که تنها این شکل بیماری را تجربه کرده اند اندک است ، اگر چه باقی ماندن نقص عصبی که ممکن است شدید باشد عموماً وجود دارد.
3) شکل تب خونریزی دهنده : نشانه های این شکل از بیماری 2 تا 4 روز پس از شروع ناخوشی ظاهر شده و با بروز اختلالات شدید کبدی چون زردی آغاز می گردد . سپس نشانه های خونریزی متعاقب آن ظاهر می گردد که عبارتند از : اسفراغ خونی ، وجود خون در مدفوع ، جوش های پوستی حصبه ای[35] یا خونریزی های زیرجلدی کشمشی(درنتیجه خونریزی های پوستی) ، خونریزی از بینی ولثه ، خونریزی های رحمی و خونریزی از محل های قطع وریدی [36] . میزان مرگ ومیر در افراد مبتلای که دچار خونریزی شده اند بالا بوده و تاحدود 50 درصد می رسد . معمولاً مرگ 3 تا 6 روز پس از آغاز نشانه ها محقق می گردد . در بیمارانی که دچار زردی ناشی از خونریزی هستند ویروس را می توان تا 10 روز در خون یافت .
میزان تلفات در انسان کمتر از یک درصد بوده ولی به هرحال در موارد بروز تب خونریزی دهنده (شکل سوم) میزان تلفات انسانی ممکن است تا 50 درصد نیز برسد . در طی یک همه گیری دامی تماس مستقیم با حیوانات مبتلا - خصوصاً مایعات بدنی – از مهم ترین عوامل خطر آفرین برای آلودگی با ویروس بیماری است . بدلیل نبود درمان اختصاصی و واکسن انسانی موثر ، بالابردن آگاهی جامعه در خصوص عوامل خطر آفرین و راه های حفاظت شخصی در مقابله با گزش حشرات تنها راه موثر در جهت کاهش آلودگی و بروز مرگ ومیر در جمعیت انسانی است . اطلاعات لازم برای آگاهی جامعه و به منظور کاستن از خطر ابتلای انسان بر روی موارد زیر متمرکز می باشد : 1) کاستن خطر انتشار آلودگی از حیوان به انسان که ناشی از شیوه های نگهداری و کشتار ناایمن و بدون حفاظت می باشد . دسکش و دیگر لباس های حفاظتی بایستی سوزانده شده و در هنگام دستکاری حیوانات بیمار و یا بافت های آلوده دامی و یا حتی در طی کشتار دام های بیمار بایستی دقت کافی به منظور پرهیز از تماس مستقیم با بافت های آلوده اعمال گردد . 2) کاستن خطر انتشار بیماری از حیوان به انسان که برخاسته از مصرف بدون اطمینان خون تازه ، شیر خام و بافت های حیوانی است . در مناطق که بیماری همه گیری یافته تمامی محصولات دامی (خون ، گوشت و شیر) بایستی کاملاً پیش از مصرف پخته شوند . 3) اهمیت حفاظت شخصی و جمعی در مقابل گزش پشه با بکار گیری از توری های آغشته به ترکیبات حشره کش ، ترکیبات دافع حشره بطور انفرادی ، پوشیدن لباس های رنگ روشن ( پیراهن آستین بلند و شلوار ساق بلند ) ، اجتناب از فعالیت خارج از منزل در زمان های اوج گزش توسط پشه های حامل .
درمان بیماری:
برای حیوانات آلوده هیچ نوع درمان اختصاصی وجود نداشته و تنها می توان به درمان های حمایتی مبادرت ورزید . در موارد انسانی استفاده از ریباویرین Ribavirin ) ) ممکن است نتایج سودمندی داشته باشد .بررسی ها نشان می دهد که اینترفرون ، واسطه های ایمنی و پلاسمای مرحله نقاهت اثرات سودمندی داشته اند .
کنترل و پیشگیری:
با توجه به شرایط آب و هوائی موثر در شیوع بیماری می توان پیشگویی های لازمه درخصوص زمان بروز بیماری و اقدامات کنترلی در راستای مقابله با بیماری را ارائه نمود.عموماً بروز همه گیری ها ارتباط نزدیکی با دوره های اوج گیری بارندگی دارد . پاسخ پوشش گیاهی به افزایش سطح بارندگی را می توان به راحتی با یک سامانه کنترل ماهواره ای اندازه گیری و مشاهده نمود . علاوه بر این همه گیری های این بیماری در غرب آفریقا بطور نزدیک در ارتباط با بارندگی های شدیدی است که در طی دوره گرمای رخداد ENSO [37] پدیدار می گردد . این یافته ها قادرند الگوهای پیش نگر سودمند و سامانه های گرمایشی اولیه ای را در تصاویر ماهواره ای مورد استفاده برای این بیماری و داده های پیش نگرانه آب وهوائی بکار بندند . این گونه سامانه های پیش نگر را می توان در یافتن موارد ابتلای دامی در مراحل اولیه همه گیری بکار برد و از این راه همه گیری های قریب الوقوع را پیشبینی نمود . امروزه در شبکه جدید کنترل بهداشتی بین المللی پیشگوئی و تعین اولیه همه گیری های بیماری تب دره ریفت به همراه ارزیابی های فراگیر در خصوص خطر و اشاعه بیماری در مناطق جدید از ضروریات لازمه به منظور اجرای کردن موثر و به موقع برنامه های کنترلی است . همچنین این نحوه نظارت و پیش آگهی از احتمال وقوع یک همه گیری اقدامات لازمه در خصوص کاهش جمعیت پشه های ناقل را پیش از بروز همه گیری اجرائی تر می کند .
به منظور مقابله با بروز همه گیری های دامی ناشی از این بیماری ارائه برنامه های مستمرمایه کوبی موثرمی باشد . مایه کوبی برعلیه بیماری در مناطق بومی شده و به منظور کنترل شیوع بیماری در جمعیت انسانی اعمال می گردد. هر دونوع واکسن زنده تخفیف حدت یافته و غیر فعال شده به این منظور تولید شده است . اخیراً عمومی ترین واکسن بکار رفته یک واکسن زنده مشتق از نژاد Smithburn بوده که در نتیجه تلقیح های مستمر در مغز موش تخفیف حدت یافته تهیه شده . یک بار تزریق این واکسن ایمنیتی 3 ساله را در پی داشته و در طی 6تا7 روز ایمنیتی قوی بوجود می آورد . ولی این واکسن موجب سقط جنین در میش های آبستن می شود . همچنین این واکسن برای انسان بیماری زا است . واکسن های غیر فعال شده نیز برای استفاده در انسان و دام تهیه شده اند . این نوع از واکسن های مورد مصرف دامی ایمن و موثر بوده ولی نیاز به دو بار تزریق داشته که بکار گیری آن را در همه گیری ها محدود می سازد . واکسن های انسانی از این نوع هنوز تحت بررسی قرار دارند که نتایج حاکی از ایمن و طولانی اثر بودن آنها است . مضافاً بر اینکه واکسن های ویروسی زنده تخفیف حدت یافته ای(چون واکسن MV P12) نیز مراحل تکمیلی را طی می نمایند . این نوع از واکسنها به نظر می رسدکه در حیوانات آبستن و شیروار بدون عارضه باشند . انجام مایه کوبی در راستای پیشگیری زمانی موثر است که پیش از وقوع همه گیری اجرای شده باشد ، انجام مایه کوبی در شرایط که همه گیری واقع شده بدلیل احتمال شدت یافتن وضعیت قابل اجرای نمی باشد . از طرفی در شرایطی که بیماری در گله حضور دارد اجرای برنامه های مایه کوبی بصورت فله ای بطور ناخواسته و سهواً سبب انتشار ویروس از طریق شیشه های واکسن و سرنگ های مورد استفاده شده و در نتیجه بر شدت همه گیری می افزاید . اعمال محدودیت یا ممانعت از نقل و انتقال دام در کاستن از سرعت انتشار بیماری از مناطق آلوده به نواحی پاک موثر است . از دیگر راه های مقابله با بیماری می توان به راه کار کنترل حاملین بیماری و محافظت از گزش توسط آنها اشاره کرد . اقدامات لازمه در خصوص نابودی لارو حشرات در مناطق تکثیر پشه ها موثرترین شیوه مبارزه با پشه های حامل بیماری است که لازمه آن شناسائی دقیق جایگاه های تولید مثلی و اعمال محدودیت در ابعاد و گسترش آن ها است .البته در طی دوره های طغیان رودها و بارش های شدید بدلیل گسترش جایگاه های تکثیر امکان کنترل عملی و مقابله با لاروهای حشرات مقدور نیست .
در خصوص پیشگیری و کنترل بیماری توجه به برخی نکات ضروریست : بایستی در صورت مشاهده سریعاً مورد را به سازمان دامپزشکی گزارش نمود ؛ وقوع بیماری را می توان با ارئه برنامه های مایه کوبی مستمر دامی پیشگیر کرد؛ بایستی دستکش و لباس های محافظ را درصورت دست کاری دام های بیمار سوزاند ؛ اقدامات احتیاطی عمومی به هنگام دستکاری و نمونه برداری از حیوانات و افراد مشکوک یا تائید شده بایستی بعمل آید ؛ محافظت از ورود پشه های حامل و کنترل جمعیت آنها ؛ استفاده از لباس های محافظ در هوای آزاد ؛ اجتناب از فعالیت خارج از منزل در طی ساعات اوج گزش و حمله پشه ها .
[1] bioterorism
[2] pleomorphi
[3] spikes
[4] ambisense
[5] assembly
[6] reassortment
[7] arthropod-borne
[8] Aedes
[9] Anopheles
[10] Culex
[11] Eretmapodites
[12] Mansonia
[13] reservoir host
[14] amplifying hosts
[15] immunocytochemical
[16] Cytopathic effect
[17] focal necrosis
[18] necrotic encephalitis
[19] . Meningoencephalitis
[20] retinitis
[21] fatal hemorrhagic fever
[23] filamentous structures
[24] lymphadenopathy
[25] Enzyme immunoassays
[26] immunodiffusion
[27] hemagglutination inhibition tests
[28] radioimmunoassay
[29] pyknosis
[30] karyorrhexis
[31] sequestration
[32] Tentative diagnosis
[33] Definitive diagnosis
[34] hallucinations
[35] purpuric rash
[36] venepuncture sites
[37] El Niño/Southern Oscillation
