بيماري هاي اخطار كردن گروه A
آبله گوسفندی وبزی
[Sheep pox and Goat pox]
تعریف :
آبله گوسفندی و بزی یک بیماری ویروسی بشدت مسری حاد یا تحت حاد(مزمن) در گوسفند وبز بوده که با بروزتب پایا ، التهاب غدد لنفاوی(لنف آدنیت)، ضایعات آبله ای عمومی شده در سراسر پوست و غشاهای مخاطی با اشکال دانه های جوش یا گرهک مانند و ندرتاً تاولی ، التهاب غشای مفروش کننده بینی [1] ، التهاب ملتحمه چشم و درغالب موارد التهاب ویروسی ریوی موضعی توام با ضایعات یک شکل پراکنده در طول ریه ها مشخص می گردد. در مواردی نیز(وقتی بیماری بومی شده) ممکن است که بیماری بصورت یک عفونت ملایم ونهفته باشد . این ناخوشی از حاد ترین بیماری های آبله ای در دام های اهلی بوده که درهمه گیری های حاصله تلفات 30 تا 50 درصدی را بدنبال دارد . بیشترین موارد تلفات در دامهای حساس جدیدی است که اخیراً وارد مناطق بومی شده اند. آبله گوسفندی در کشورهای که بطور گسترده پروش دهنده گوسفند می باشند بدلیل تلفات حاصل از بیماری ، کاهش باروری ، افت کیفیت پشم و چرم ،کاهش تولید شیر و ایجاد محدودیت ناخواسته در تجارت بین المللی از اصلی ترین خطرهای صنعت دامپروری بشمار می رود . عامل بیماری در تروریسم کشاورزی [2] کاربرد داشته و در لیست USDA قرار دارد.
تاریخچه بیماری :
آبله گوسفندی و بزی یک بیماری کهن شناخته شده برای بشراست . طبیعت مسری آن برای نخستین بار در سال 1763 معین شد و سبب شناسی و روند بیماری زائی آن اولین بار در سال 1868 مورد مطالعه قرار گرفت . آبله گوسفند بطور عمیقی در سال 1903 توسط بورل بررسی گردید . آبله گوسفندی و بزی در حال حاضر در آفریقا (شمال اکوادور و مصر) ، خاور میانه شامل ترکیه ، عراق ، ایران ، افغانستان و هندوستان بصورت بومی است . همه گیری های منفردی نیز در جنوب شرقی اروپا گزارش شده . بیماری برای اولین بار در انگلستان (1847) و در میان گله منتقل شده ای ظاهر گردید ، آخرین مورد همه گیری بیماری در این کشور به تاریخ 1866 باز می گردد. اغلب نقاط اروپا و آمریکا امروزه عاری از حالت بومی است ، اگر چه بیماری در سال 2000 در کشور یونان بروز کرده .
سبب شناسی بیماری:
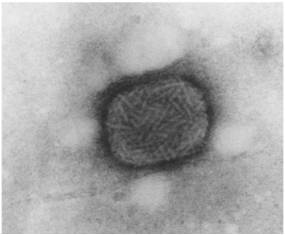
عوامل ویروسی بیماری آبله گوسفندی و بزی دو ویروس متعلق به خانواده پاکس ویریده (Poxviridae) تحت خانواده کوردوپاکس ویرینه Chordopoxvirinae) ) و جنس کاپری پاکس ویروسCapripoxvirus)) می باشند . ویروس آبله گوسفندی(SPV) و ویروس آبله بزی (GPV) از اعضای بسیار نزدیک جنس کاپری پاکس ویروس می باشند . بسیاری از اشتقاقهای این جنس میزبانهای اختصاصی داشته بطوری که GPV عمدتاً موجب بیماری در گوسفند و GPV غالباً سبب درگیری بزها می شوند . ولی به هر حال برخی از اشتقاق ها این جنس ویروسی در هر دوگونه دامی بیماری زا هستند . با بکار گیری شیوه های تشخیصی سرم شناختی ( خنثی سازی ویروسی) نمی توان این دو نوع ویروس را از هم تمیز داد و می توان آنها را نژاد هائی از یک ویروس واحد دانست .داده های حاصل از سرم شناسی ، عفونت های متقاطع و ایمنی متقاطع حاکی از این واقعیت است که ویروس های مسبب بیماری غیر قابل تمیز بوده و آنها را می توان مجموعه ای از یک بیماری واحد تصور نمود. ترتیب توالی ژنیتیکی هر دو نوع ویروس نیز حاکی از مجزا بودن آن دو است ، ولی امکان بروز نوترکیبی مابین آن دو وجود دارد. نژاد های نوترکیبی یافته ویژگی میزبانی حد واسط دارند . اشتقاق های این دو نوع ویروس از نظر حدت و ویژگی میزبانی متنوع بوده بطوری که در خاور میانه و هند دو نوع ویروس ظاهراً ویژگی میزبانی داشته ولی در کنیا نژاده هائی حضور دارند که هر دو نوع گونه دامی را درگیر می نمایند . هر دو نوع ویروس SPV و GPV بطور نزدیک در ارتباط با ویروس نیتلینگ عامل بیماری پوست قلنبگی (LSDV) می باشند . ارتباط مابین این سه ویروس مورد تائید واقع شده ولی در تجزیه و تحلیل های اخیر این کمان مطرح شده که GPV و LSDV بیشتر از دیگر مورد با یکدیگر مرتبط هستند . ویروس های SP&GP در محیط های کشت بافتی متنوعی چون کلیه بره و گوساله و انواع یاخته ها تکثیر می شوند ، در کشت یاخته های بیضه و ریه جنین گاوی اثرات مرگ یاخته ای (CPE) را بدنبال داشته که بسته به نژاد ویروس ونوع یاخته متفاوت است . برخی ار نژاد های ویروس در غشای کوریو آلانتوئیک تخم مرغ جنین دار ضایعاتی را ایجاد می نماید .
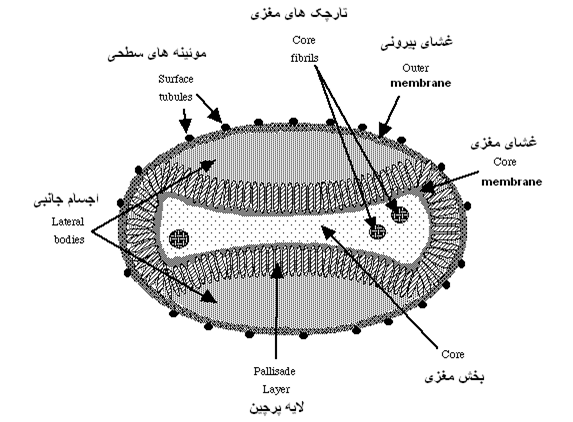
از نظر ریخت شناسی ویروس های این بیماری از بزرگترین ویروس های شناخته شده بوده با شکل تخم مرغی یا
آجری با ابعادی 170 تا260 در 300 تا 450 نانومترو قابل مشاهده با میکروسکوپ نوری
مناسب می باشند . هر ویشه ویروسی محتوی
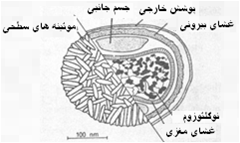
بیش از 100 پلی پپتید است که در چهار ساختار مجزا مرتب شده اند : 1) پوشش ویروس(Envelope) 2) غشای ویروس (Membrane)
که خود بر دو نوع است غشای بیرونی و غشای مغزی 3) اجسام جانبی و 4) بخش مغزی . غشای
مغزی ویروس در واقع یک غشای دولایه ای لیپوپروتئینی با ضخامت 50 تا 55 نانومتر است
که بخش مغزی را در برمی گیرد و غشای بیرونی ویروس توسط عناصر موئینه سطحی (STEs)[3] با ترتیب تصادفی آراسته شده. این موئینه ها بطور میانگین دارای قطری
7 نانومتری و طولی 100نانومتری بوده و برای ویشه ویروس سطحی تارو پود دار، خشن و
نامسطح را فراهم می کنند . محتوای کلسترولی و فسفولیپیدی غشای ویروسی به نظر می
رسد که قادر نباشد تا لایه دوتائی لیپیدی پیوسته ای را در پیرامون ویروس ایجاد
نماید که در نتیجه آن عناصر موئینه سطحی بداخل این غشای دولایه ای لیپیدی نسبی
وارد می شوند .غشای بیرونی ویروس حداقل از 12 نوع پلی پپتید تشکیل شده که در این
میان بیش از 6 نوع آن در سطح بیرونی غشای بیرونی ملحوظ هستند . این نوع پلی
پپتیدها عبارتند از 1) یک پلی پپتید 54 تا 58 کیلودالتونی(STE) 2) یک یا دو پلی پپتید 35 کیلودالتونی 3) و یک پلی پپتید 14 کیلو دالتونی . با روش
تجزه ای خاصی (Western immunoblot analyses)
مشخص شده که ایمنی زاترین نواحی پلی پپتید سطح ویروس یک پلی پپتید 35 کیلودالتونی
است به میزان زیادی در نونیدیت P-40 محلول بوده و دارای یک بسط آب گریز از اسید های
آمینه ای است که با جایگاه غشاگذر در غشای بیرونی سازگار بوده و بطور جالب توجهی
دارای توالی اسید های آمینه ای مشابه با گلیکوپروتئین نوع G ویروس یکپارچه گر تنفسی (RSV)
است . دومین پلی پپتید 35 کیلودالتونی با ویژگی های مشابه نوع اول نیز وجود دارد
که توالی اسید های آمینه آن مشابه کربنیک آنهیدراز است . بررسی ها نشان می دهد که
حضور این نوع پلی پپتید در جهت روند همانند سازی ویروس غیر ضروری است . اخیراً یک
پلی پپتید استیله شده 25 کیلودالتونی نیز معین شده . عموماً ویشه ویروسی دارای بخش
مغزی و اجسام جانبی و غشاهای مغزی و بیرونی می تواند برای میزبان های حساس عفونت
زا باشد . در برخی از سویه های ویروسی و در برخی از یاخته های میزبانی ویروس علاوه
بر سه بخش عنوان شده دارای یک پوشش کلی نیز می باشد که تمامی ویشه ویروسی را دربر
می گیرد و آن را اصطلاحاً پوشش (Envelope)
می نامند. بعنوان نمونه در ویروس واکسینا حداقل 7 نوع گلیکوپروتئین مجزا وجود دارد
که عبارتند از: گلیکوپروتئین های 210، 110 ، 89(هماآگلوتینین ویروس) ، 42 ، 5/21 ،
21 و 20 کیلودالتونی . همچنین یک پلی پپتید اصلی غیر گلیکوزیله اما استیله 37 کیلو دالتونی دیده می شود . در
روند کسب پوشش ویروسی عشای ویروس در معرض روندی قرار می گیرد که در آن پروتئین های
200 ، 95 و 13 کیلودالتونی حذف شده ، سطح پروتئین های 65 و 30 کیلودالتونی تقلیل
یافته و میزان پروتئین های 27 کیلودلتونی افزایش می یابد . پوشش ویروس در مقایسه با ویشه های فاقد پوشش
حدوداً تا 2 برابر بیشتر فسفولیپید دارد اما در هردو (پوشش دار و فاقد پوشش) نسبت
فسفولیپید های خنثی به بار منفی دار اندک می باشد . بررسی ها نشان می دهد که پادکن
های ویروسی موجود در پوشش ویروس قادرند
ایمنیتی را برانگیزند که در مابل تهاجم ویروسی مدافعه گر می باشد .
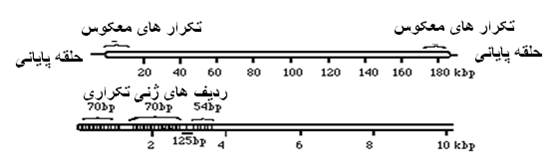
کپسید ویروسی محتوی یک ژنوم DNA دو رشته ای ، غیرمنقطع ،خطی با تعداد تقریبی 150 کیلوباز که توسط لایه لیپیدی که در حکم یک پوشش واقعی نیست محصور گردیده . پایانه های ژنوم ویروس دارای حلقه شبیه سنجاق مو (بدون آزاد بودن پایانه) همراه با چندین جفت ردیف ژنی تکراری است (این ترتیب ژنی در پایانه های کرموزومی تعدادی از ریزاندامگان مختلف یافت می شود) . پایانه های ژنومی تشکیل توالی های ژنی تکراری مستقیمی را می دهند که به آنها تکرارهای پایانه ای معکوس می گویند(ITRs)[4] . غالب ژن های لازم در بخش مرکزی ژنوم ویروسی جای گرفته ، درحالی که ژن های غیر ضروری در پایانه های ژنوم ویروس قرار دارند .
ویروس آبله دارای سه شکل عفونی است : 1)ویروس بالغ داخل یاخته ای (IMV) 2)ویروس لفافه دار(پوشش دار) داخل یاخته ای (IEV) و 3) اشکال خارج یاخته ای ویروس دارای 2 غشای بوده و اصطلاحاً به این اشکال ویشه ها(ویریونهای) پوشش دار خارج یاخته ای(EEV)[5] اطلاق می گردد. ذرات ویروسی داخل یاخته تنها دارای یک غشای داخلی هستند و به این اشکال اصطلاحاً ویشه های داخل یاخته ای بالغ اطلاق می گردد(IMV)[6] . مقاطع ظریف میکروسکوپ الکترونی از ویروس نشان می دهد که سطح خارجی متشکل از لیپید و پروتئینی است که بخش مغزی را احاطه می نماید ، بطوری که این لایه ها مقعر(دمبلی شکل) وتوام با دو جسم جانبی (عملکرد نامعین) هستند . بخش مغزی ویروس متشکل از یک نوکلئوپروتئین به شدت فشرده است .
همانند سازی و تکثیردر داخل سیتوپلاسم یاخته آلوده صورت می گیرد ، ویروس پیچیدگی و قابلیت کافی جهت کسب توانائی های لازمه در خصوص تکثیر ژنومی را دارا است .طول مدت زمان این چرخه در خانواده ویروس های آبله بسیار متغییر است ، درویروس های عامل بیماری در گوسفند و بز معمولاً سریع بوده و 12 ساعت بطول می انجامد. در این روند تکثیر نقش یاخته میزبانی نیز مطرح بوده ولی به روشنی این امر شناخته نشده . بیان ژن و همانند سازی ژنومی این ویروس در یاخته های فاقد هسته ممکن است اما به بلوغ رسیدن آن متوقف می گردد . گیرنده های دخیل در اتصال ویروس به یاخته های میزبان هنوز به درستی معین نیستند ولی در خصوص واکسن ها یکی از موارد تائید شده گیرنده های EGF[7](عامل رشد اپیدریمی) است . نفوذ ویروس دریاخته میزبان (Penetration) رخدادی پیچیده بوده که ممکن است بیش از یک سازو کار در آن دخیل باشند .در برخی از ویروس ها مشخص گردیده که این عوامل دارای یک لیگاند مهم و اصلی بعنوان گیرنده واسط برای اتصال به یاخته هستند ولی در خصوص ویروس های آبله این امر به اثبات نرسیده. در بسیاری از برسی های بعمل آمده پیرامون سازوکار این چرخه، شکل فاقد پوشش ویروس واکسینا مورد ارزیابی قرار گرفته است . شواهد حاصل از مشاهدات ریزبینی الکترونی و همچنین توانمندی ویروس در آلودن یاخته های میزبانی در حضورترکیبات لیزوموتروفیک [8] این کمان را مطرح می سازد که روند همجوشی مستقل از PH با غشای پلاسمایی یاخته میزبان مهمتر از همجوشی اندوزومی وابسطه به PH پائین –که توسط ویروس آنفولانزا بکار می رود- می باشد .بطور مشابه نیز ویروس های پوشش دار آبله با الگوئی مستقل از PH با غشای پلاسمائی یاخته میزبان همجوشی می یابند ، اگر چه سینتیک این روند بسیار سریع تر از ویروس های فاقد پوشش آبله ای است . ورود ویروس به داخل یاخته میزبان را می توان با بکار گیری پادتن های منوکلونال مخالف هر کدام از پنج پلی پپتید سطحی غشای بیرونی ویروس و همچنین آنتی سرم پلی کلونال تولید شده توسط موش و خرگوش های آلوده متوقف ساخت . یافته فوفق این نظریه را مطرح می سازد که پلی پپتید 32 کیلودالتونی ، پلی پپتید 29 کیلودالتونی و ناحیه ای از پلی پپتید های 54 تا 58 کیلودالتون (STE) در اتصال ویروس به یاخته هدف حائز اهمیت است . در خصوص روند نفوذ به داخل یاخته میزبان تصور بر این است که یک ناحیه پلی پپتیدی ثانویه 54 تا 58 کیلودالتونی ، یک پلی پپتید 34 کیلو دالتونی و پلی پپتید دو جزئی 17-25 کیلو دالتونی موجود است که در روند دخول از مرحله نفوذ ویروس حائز اهمیت می باشد ، بطوری که لازمه این این روند یک رخداد شکافت و تجزیه پروتئینی (پرتئولیتیکی) است که توسط ترپسین یا اجزای خرد شده غشای پلاسمائی پشتیبانی می گردد . بررسی های زیست شیمیائی و ریزبینی الکترونی در خصوص پوشش زدائی ویروسی(Uncoating) نشان می دهد که ویشه ویروسی به هنگام ورود به داخل یاخته میزبان حد اقل در دو مرحله مجزا ساختار زدائی می گردد. مرحله اول حذف غشای بیرونی به هنگام دخول ویروس به یاخته و سیتوپلاسم است که در این مرحله پروتئین ها و لیپید های ویروسی حذف می شوند ، اگر چه ژنوم ویروس همچنان در بخش مغزی باقی مانده ومجزا می باشد . در طی دومین مرحله غشای پوشاننده ژنوم ویروس نیز حذف شده و DNA آن وارد سیتوپلاسم یاخته می گردد.این مرحله از پوشش زدائی را می توان با بکار بردن اینترفرون مهار نمود .به نظر می رسد که حداقل میزان بیان ژنی به منظور انجام یافتن روند پوشش زدائی مورد لزوم بوده و یک پروتئین 23 کیلودالتونی با فعالیت شبه ترپسینی مختص یاخته های آلوده ظاهراً به همراه ان روند محقق می گردد . بیان ژنی (Gene expression) توسط آنزیم های محقق می گردد که دربخش مغزی ویروس آن را همراهی می کنند . تقریباً با ورود ویشه ویروسی به داخل یاخته میزبان دستگاه رونوشت برداری ملازم ویروس به فوریت فعال می شود . این روند بیان ژنی در سه مرحله اجرای می گردد ، در مرحله نخست ژن های اولیه که در حدود 50٪ ژن های ویروس هستند پیش از شروع روند همانند سازی ژنومی رونوشت برداری و ترجمه می شوند (بیان ژن)، در نتیجه مجموعه ای از رونوشت های مختص ویروسی که کلاهدار و آدنیلات دار شده هستند و تا 50٪ شبیه ژنوم ویروسی می باشند تولید می گردد . محصولات حاصل در این مرحله روند همانند سازی DNA ویروس را حمایت کرده وعملکرد یاخته را تنظیم می نمایند . برسی های بعمل آمده عوامل ویژه ای را مشخص ساخته که وابسته به آغاز و اختتام بیان اولیه ژنومی و نیز توالی های DNA است که شناخته شده اند . بعنوان مثال در ویروس واکسینا عامل رونوشت برداری اولیه حاوی پلی پپتید های 82 و 77 کیلودالتونی است و احتمالاً بصورت یک ترکیب دوجزئی (دیمر) است . این عامل به پیشبرنده [9] اولیه متصل شده و موجب آغاز روند رونوشت برداری می گردد. اختتام روند رونوشت برداری اولیه حدوداً 50 نوکلئوتید پائین تر از توالی TTTTNT محقق شده که در آن N می تواند هر نوکلئوتیدی شامل T باشد . این محصولات ژنی اولیه در واکنش های داخلی میزبان و در DNA و احتمالاً سنتز RNA دخیل هستند . بررسی ها نشان می دهد که یک DNA پلیمراز ، تیمیدین کیناز ، تیمیدیلات کیناز و ریبونوکلئوردوکتاز را ویروس کد گزاری و بیان اولیه می نماید . این سه فعالیت آنزیماتیکی آخری جالب توجه است چرا که پیش سازهای لازم برای سنتز DNA را تا یک سطح مناسب تامین کرده ، و در مقابل اثر کلاس های مشابهی از آنزیمهای میزبانی شامل کنترل چرخه یاخته ، و یا جایگاه واکنش هسته ای نقش تخفیف دهنده دارد. دیگر تغییرات داخل یاخته ای ناشی از ویروس که به عملکرد ژنی اولیه منسوب است از تغییر در ساختار اسکلتی سیتوپلاسم یاخته گرفته تا قطع تولید ملکول های درشت پیکر و مهار اثرات ضد ویروسی ناشی از اینترفرون متنوع می باشد . اثرات محصولات ژنی اولیه محدود به داخل یاخته نبوده و بواسطه ترشح پروتئین هائی همچون عامل رشد ویروسی (VGF)[10] و پروتئین متصل به کمپلمان ویروس واکسینا (VCBP) [11] اثرات خارج یاخته ای نیز دارند. در مرحله دوم ژن های حد واسط (میانه) بیان شده که محصولات حاصله تمایل به تنظیم عملکرد های یاخته ای دارند . در مرحله سوم ژن های تاخیری پس از همانند سازی ژنومی بیان می شوند، چراکه فعالیت این پیش برنده های نهائی (late promoters) وابسطه به همانند سازی DNA هست محصولات حاصله در این مرحله نیز در روند گردآیش اجزای ویروسی ایفای نقش می نمایند . به نظر می رسد که تولید DNA ویروس و اثر حداقل 3 ژن تنظم کننده حد واسط (پروتئین های کدگزاری شده 17، 26 و 30 کیلودالتونی) به منظور بیان ژنی تاخیری مورد نیاز می باشد . بیان ژنی تاخیری دارای چندین ویژگی می باشد: پیشبرنده حاوی یک توالی ژنی TAAAT است که در آن رونوشت برداری آغازمی گردد ، هیچ نشانه اختتامی عمل کننده نوع سیس در انتهای ′3 ژن موجود نیست ،روند همجوشی RNA قابل تشخیص نیست و حداقل یک عامل رونوشت برداری جدید 30 کیلودالتونی وجود دارد، بطوری که محصول یکی از ژن های تنظیم کننده حد واسط می باشد . معمولاً نیم عمر mRNA تاخیری(نهائی) کوتاه تر از mRNA اولیه است . همزمان با ظهور پروتئین های نهائی روند تولید اغلب پروتئین های اولیه متوقف می گردد مگر در هنگامی که از قبل قالب باز شده DNA در حال ترجمه (ORF) [12]تحت تاثیر جفت پیش برنده ها واقع شده باشد. پروتئین های که در مراحل آخری تولید می شوند شامل غالب پروتئین هائی ساختاری و همچنین بسیاری از آنزیم هایی است که فعالیت آنها برای روند گردآیش ویشه های ویروسی سلاله دودمانی[13] است . برخی از پروتئین ها نیز پیش از روند گردآیش یا در طی آن تحت واکنش های گلیکوزیلاسیون ، فسفوریلاسیون و واکنش های تسهیمی قرار می گیرند . از mRNA ژن تاخیری (نهائی) حد اقل سه پلی پپتید (25،35و37 گیلودالتونی ) تولید شده که پیش از ادغام در ویشه یروسی استیله می گردند . این استیله شدن ممکن است در واکنش های پروتئین با پروتئین یا پروتئین با لیپید حائز اهمیت باشد .
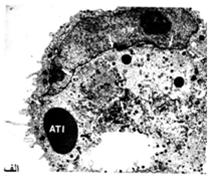
(Genome replication): اعتقاد بر این است که همانند سازی ژنومی ویروس های آبله مستقل از هسته میزان بوده و در نواحی پراکنده ای از سیتوپلاسم که مراکز تولید یا ویروپلاسم [14] نامیده می شوند محقق می گردد. بطوری که این نواحی به سادگی توسط ریزبین الکترونی و بواسطه ظاهر دانه دار(گرانوله) و فقدان اندامک های یاخته ای در این نواحی قابل تمیز می باشند . این نواحی (همچون یک گودال) با رنگ های بازوفیلی چون هماتوکسیلین ائوزین واکنش داشته و در زیر میکروسکوپ نوری بصورت ساختار های پراکنده ای که از آن بعنوان اجسام گنجیدگی نوع B یاد می شود قابل مشاهده اند (پیکان های سفید در تصویر الف ).

تفکیک نوترکیبی های خود بخودی در توالی های انتهایی ژنوم گونه های منفرد ویروس های آبله و مشاهده تنوعی قابل توجه در ساختار ژنوم انتهایی بین گونه های مختلف ویروس آبله احتمالاً ناشی از نوترکیبی غیرمتعارف و متعارف توام با فقدان ظاهری یک محدوده فشرده سخت بر روی DNA است . این جنبه ویژه روند همانند سازی ژنومی ویروس آبله شیوه ای را برای بسط ژنومی فراهم می آورد که خود راهی است بسوی تکامل یا پیدایش توانمندی های جدید در ویروس .

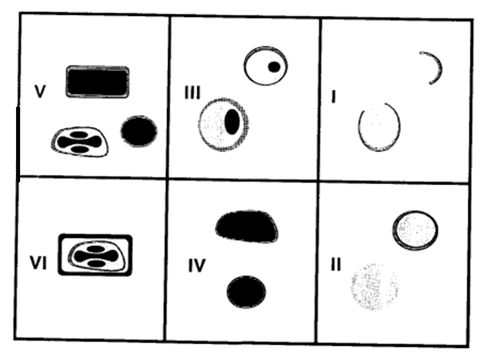
همانند سازی ژنومی شامل خود آستر سازی[15] است که منجر به تشکیل ساختار های مولکولی حد واسطی می گردد که تا 200 ملکول طول داشته به یکدیگر متصل شده و تشکیل ملکول های درشتر با وزن ملکولی بالائی را می دهند که کانکاتمر[16] نامیده می شوند ، این ملکول های سنگین وزن را می توان از یاخته های آلوده به ویروس آبله جدا نمود . ملکول های فوق متعاقباً شکافته و ترمیم شده تا اینکه ژنوم ویروسی پدید آید . بسیاری از آنزیم های رمزگذاری شده ویروسی در روند همانند سازی ایفای نقش می نمایند (مانند تیمیدین کیناز TK) این آنزیم ها در واقع می توانند بعنوان اهداف بالقوه ای در خصوص تهیه ترکیبات درمانی موثر مورد نظر باشند . گردآیش اجزای ویروسی (Assembly) که در داخل ساختار های اسکلتی یاخته ای [17] تحقق می پذیرد ، باتوجه به توانمندی ژنتیکی ویروس در تولید حدود 200 پلی پپتید و به لحاظ مولکول های درشت پیکر خاص ویروس های آبله رخدادی پیچیده است . نخستین ساختار هائی خاص ویشه ای که در طی عفونت ویروسی قابل تمیز هستند اشکال هلالی شکلی می باشند که دارای یک لایه دوقسمتی لیپوپروتئینی با قطر50 تا 55 نانومتری است .این اشکال هلالی بطور گسترده با لایه ای از خارها [18]پوشیده شده و از قسمت داخل مجاور با اجزای جاذب الکترون (الکترون دنس) و دانه دار است(تصویر ب). بی شباهت به غشای دیگر ویروس ها ی پوشش دار همچون تورم تاولی دهان یا آنفولانزا ، به نظرنمی آید که غشای ویروس آبله با غشای یاخته میزبان پیوستگی داشته باشد . بلکه ظاهراً در ویروپلاسم به ترتیب ذرات یکنواخت ، بعد کروی ونهایتاً نابالغ گردآیش می یابند.اعتقاد بر این است که خارهای پوششی متشکل از پلی پپتید های 65 کیلودالتونی می باشند ، این ساختار های خاری بعنوان یک داربست موقتی عمل کرده ، به ذرات نابالغ شکل مشخصی می دهند . این ذرات نابالغ فاقد شمار زیادی از پلی پپتید های ساختاری ویشه ویروسی بالغ بوده که شامل پلی پپتید های مغزی اصلی ، a4وb4 وSET 54 تا 58 کیلودالتونی می باشند. این ذرات نابالغ ویروسی دستخوش تغییرات ریخت زائی و زیست شیمیائی گسترده ای در محتوای داخلی و خارجی می شوند ، روندی که اطلاعات اندکی در مورد آن وجود دارد . بر اساس بررسی های هاروان ویوهن ، شش مرحله مجزای در روند ریخت زائی ویشه ویروسی وجود دارد : نوع اول هلالی ، نوع دوم ذرات نابالغ بسته ، نوع سوم ذرات نابالغ بسته دارای هستک ، نوع چهارم شکل گیری مغز اولیه ر داخل غشای ، نوع پنجم ویشه بالغ و نوع ششم ذره نوع پنجم با پوشش(تصویر ذیل)
در طی مراحل ریخت زائی فوق ژنوم DNA، آنزیم های فعال و پلی پپتید های ساختاری جورشده وارد ذره ویروسی بالغ می شوند . برخی از پلی پپتید ها مانند پلی پپتید های مغزی اصلی a4 و b 4 در نتیجه روند پروتئولیتیک در طی مرحله بلوغ ویروس پدیدار می شوند . خارهای 65کیلودالتونی بر روی غشای بیرونی توسط موئینه های سطحی 54 تا 58 کیلودالتونی جای گزین می شوند، روندی که برای تغییر شکل از ویشه کروی به ویشه آجری با ظاهری از مغز استخوان سگی شکل و اجسام جانبی همراه آن ، حائز اهمیت است . در مراحل نهائی روند ریخت زائی ویشه ویروسی، ویشه ها به خارج از ویروپلاسم منتقل می شوند . بسته به نوع ویروس آبله و یاخته میزبان، توالی رخدادهای مربوط به انتشار ویروس متنوع است . ولی معمولاً ویشه ویروسی یکی از مسیرهای زیررا دنبال خواهد نمود :
1) بصورت آزاد در سیتوپلاسم .
2) به سطح یاخته مهاجرت کرده و در داخل ریز خمل ها [19] استقرار می یابد .
3) توسط دو غشای مشتق از دستگاه کلژی لفافه شده ، به سطح یاخته منتقل و با پوشش حاصل از غشای داخلی دستگاه کلژی از یاخته رها می شود .
4) به روند جوانه زنی بداخل یک واکوئل نسبتاً بزرگ پوشش را کسب می کند .
5) با واکوئل های پیوندی فاقد غشای در می آمیزد .
6) ویا با مواد پروتئین دار درآمیخته و ساختار های اسید وفیل و سیتوپلاسمی تحت عنوان اجسام گنجیدگی نوع A (ATIs) [20] را ایجاد می کند .
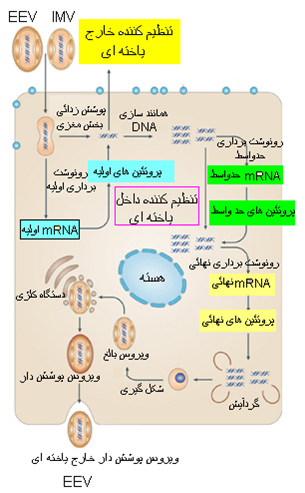
چرخه ویروس آبله
تشکیل اجسام گنجیدگی نوع A در تمامی گونه های ویروس آبله مشاهده نمی شود . این اشکال را می توان در آلایش با ویروس Ectromelia ، ویروس آبله راکون ، ویروس آبله مرغی و ویروس آبله گاوی مشاهده نمود . سه نوع از این اجسام گنجیدگی قابل تمیز است . برخی از این اجسام فاقد ویشه های ویروسی هستند که آنها را با شاخص – V نشان می دهند، در حالی که دیگر انواع دارای ذرات حقیقی ویروس را با نشانه + V مشخص می سازند، در تعدادی از این اجسام گنجیدگی ویشه ها در سطح اجسام گنجیدگی قرار دارند که آنها را با نشانه i V معین می کنند . شاخص + V یک ویژگی مختص به گونه ویروسی است و به نظر می رسد که حداقل ناشی از دو محصول ژنی است : یکی عامل جفت ساز ویروس [21]و دیگری پروتئین اصلی ATI . عامل جفت ساز ویروس در مراحل اختتامی چرخه عفونت ویروس تولید شد با سطح ویشه ویروسی در آمیخته و موئینه های سطحی ویروس را ایجاد می نماید . پروتئین اصلی ATI نیز در مراحل نهائی چرخه ویروس ظاهر شده و در آبله گاوی اساساًمتشکل از یک پلی پپتید 160 کیلودالتونی است . اگر چه وجود این اجسام گنجیدگی نوع A در تمامی مهره داران - علارغم داشتن ژنی برای این پلی پپتید- به اثبات نرسیده ولی اعتقاد بر این است که پیش از وجود جمعیت میزبانی حساس و تاحد لازم کافی در جهت ادامه بقاء و انتشار اجداد ویروس های آبله ، حضور این اجسام گنجیدگی راهی را برای حفظ و ابقاء ویروس در محیط فراهم می آورد .
به لحاظ پادگنی ویروس های آبله بسیار پیچیده بوده ، موجب تولید پادتن های اختصاصی و واکنش متقاطع شده بنابر این می توان با استفاده از یک واکسن از دیگر ویروس ها نیز ایمن شد . حداقل 10 نوع آنزیم در داخل یک ویشه ویروسی موجود است که غالباً در ارتباط با سوخت و سازاسید های هسته ای و همانند سازی ویروسی هستند .
در تحت شرایط عادی محیطی ویروس بسیار پایدار بوده و می تواند تا 3 ماه در اجزای زخم های دلمه بسته فعال بماند . در مکان های تاریک وخنک قادر است تا 2 سال زنده مانده و در اشیای آلوده تا یک دوره شش ماهه فعال است . هر دو نوع ویروس توسط نور مستقیم خورشید در طی چند دقیقه تخریب شده و نسبت به اتر و کلروفرم حساس هستند . ترکیات ضد عفونی کننده عمومی خصوصاً یدوفور ها و کلر هگزیدین بر ویروس موثر هستند . ویروس های خانواده پاکس ویریده ، جنس کاپری پاکس ویروس نسبت به تاثرات فیزیکی و شیمیائی مقاوم است .ویروس دمای 56 درجه سانتی گراد را تا 2 ساعت و 65 درجه سانتی گراد را تا 30 دقیقه تحمل می کند. ویروس نسبت به محیط های با PH قلیائی بالا یا اسیدی حساس است . ویروس نسبت به ترکیبات شیمیائی چون اتر 20٪ ، کلرفورم و فرمالین 1٪ حساس است . ترکیبات ضدعفونی کننده ای چون فنل 2٪ ویروس را در طی 15 دقیقه غیر فعال کرده و همچنین ویروس نسبت به ترکیبات پاک کننده ای چون دودسیل سولفات سدیم حساس است .
همه گیر شناسی:
کاپریپاکس ویروس ها تنها در گوسفند و بز ایجاد بیماری می کنند(میزبان های طبیعی) . بسیاری از مشتقات SPV برای گوسفند اختصاصی بوده و تعداد کثیری از مشتقات GPV نسبت به بز مختص می باشند ، اما در این میان هستند اشتقاق هائی که به سادگی هر دو گونه دامی را تحت تاثیر قرار می دهند . در مناطقی که بیماری وقوع فصلی دارد نژادهای انتقال یافته در مقایسه با نژاد های داخلی حساس تر می باشند .بره ها و بزغاله ها به میزان و شدت بیشتری در مقایسه با بالغین درگیر می شوند . هیچ گونه گزارشی مبنی بر درگیری زوج سمان وحش وجود ندارد . ویروس می تواند در بدن گاو تکثیر یابد ولی بیماری زا نیست . همه گیری های شدید معمولاً در طی فصول سرد سال واقع شده و عموماً در گیری در دامهایی دیده می شود که در اثر آلودگی های انگلی تضعیف شده اند .
شدت بیماری از نظر میزان واگیری و تلفات بسته به نژاد ویروس ، سن دام ،نژاد دام ومیزان ایمنیت دام در برابر ویروس های آبله متفاوت است .در گوسفندان وبزهای بالغ میزان واگیری ممکن است تا 80 درصد برسد .میزان تلفات نیز تا 50 درصد می تواند برسد.در بره ها و بزغاله ها زیر یک ماه میزان واگیری ممکن است تا 100 و میزان تلفات تا 95 درصد برسد . در مناطقی که بیماری بومی است میزان واگیری در نژادهای بومی منطقه از 1 تا75 درصد متغییر می باشد ، اگرچه میزان تلفات در چنین مناطقی کمتر از 10 درصد است ولی در مواردی که نقل و انتقال دامی صوت گرفته و همچنین در دامهای جوان این میزان ممکن است که به 100درصد گله برسد . بطور کلی عفونت های ملایم در نژادهای دامی داخلی مناطق بومی شده بیماری دیده شده و شکل شدید بیماری نیز در حیوانات جوان تحت استرس ، دامهایی که همزمان در معرض دیگر عفونت ها بوده ویا دامهای تازه وارد شده ای که از مناطق عاری از بیماری آمده اند قابل مشاهده است . عواملی که ممکن است موجب پیچیده تر شدن دوره بیماری و افزایش میزان تلفات گردند عبارتند از: فقر تغذیه ای ، آلودگی های انگلی شدید و شرایط آب و هوائی نامناسب .
انتشار بیماری به روش مستقیم و یا غیر مستقیم صورت می گیرد. درغالب موارد SPV و GPV از طریق مسیر تنفسی و درطی تماس نزدیک منتقل می گردند . استنشاق ذرات معلق آلوده حاصل از دام های بیمار ، ذرات معلق ایجاد شده از غبار آلوده حاصل از دلمه های آبله ای در آغل ها و نواحی اوتراق شبانه و تماس غیرمستقیم خراش های پوستی با اشیای آلوده یا بطور مستقیم با ترشحات آلوده دامی راه های طبیعی انتشار ویروس به شمار می روند ، ولی این امکان نیز متصور است که ویروس بتواند از راه دیگرپرده های مخاطی نیز وارد بدن میزبان گردد. ترشحات ضایعات پوستی و دلمه های خشک شده اصلی ترین منابع ویروس به شمار می روند ولی به هر حال ویروس را میتوان در بزاق ، ترشحات چشمی و بینی ،شیر، ادرار و مدفوع ، پشم ، مو و ذرات معلق تنفسی ، خون دامی که در مرحله انتشار خونی ویروس است (2-4روز) و جنین های سقط شده یافت. این موضوع که ویروس عامل بیماری از طریق مایع منی یا جنین قابل انتقال می باشد یا نه؟ هنوز بدرستی مشخص نیست .امکان انتقال ویروس توسط حشرات (حامل مکانیکی) نیز ممکن می باشد . تلقیح داخل وریدی ، داخل جلدی، داخل بینی یا زیر جلدی ویروس می تواند بیماری را بطور تجربی بوجود آورد . پیش از ایجاد پادتن های خنثی گر ویروسی که حدوداً یک هفته پس از شروع نشانه های بالینی است ، دام بیمار بیشترین قابلیت انتشار ویروسی را دارد. گوسفندان و بزهایی که بطور تجربی آلوده شده اند ویروس های آبله را در ترشحات بینی ، ملتحمه ای و دهانی به مدت 1 تا 2 ماه دفع می کنند ، اما اوج این مرحله دفع ویروسی در طی دومین هفته تلقیح ویروس است ، که از آن پس این میزان ترشح ویروسی به سرعت کاهش می یابد . ناقلین عفونی مزمن در این بیماری مشاهده نمی شوند . همچین ویروس های SPV و GPV قادرند بر روی اشیای یا بطور مکانیکی توسط حشراتی چون مگس اسطبل (Stomoxys calcitrans) منتشر شوند، اگر چه این راه انتشارازنادرترین مسیرهای انتقالی است . ویروس بیمار قادر است در آغل های سایه دار گوسفندی تا 6 ماه بصورت عفونی پایدار بماند . این عوامل ممکن است تامدت مدیدی پس ازبروز عفونت (3 ماه) بر روی پشم و موهای دام واحتمالاً به مدت بیشتری بر روی دلمه ها باقی بمانند . واین که آیا این ویروس های موجود در دلمه قابلیت عفونی دارند یا نه مشخص نیست.
از نقطه نظر جغرافیائی آبله گوسفندی وبزی در برخی از بخش های آفریقا ، خاور میانه ، بخش هائی از آسیا شامل شبه قاره هند و چین مشاهده شده و در این مناطق بصورت بومی است . مرکز آسیا تا خاورمیانه و حوزه مدیترانه که از آن تحت عنوان جاده نشخوارکنندگان اروپائی آسیائی[22] یاد می شود در طی صدها سال مهمترین دالان مهاجرتی برای بسیاری از نژادها شامل انسان و نشخوار کنندگان وحشی و اهلی بوده و نشخوار کنندگان کوچک نقش مهمی را در انتشار بیماری ها واز جمله آبله به چند دلیل داشته اند ، نخست اینکه این نشخوارکنندگان ممکن است نشانه های بارز بیماری را نشان ندهند، نژاد های کوچ کننده (چادرنشینی) پیش از بروز نشانه ها مهاجرت می کنند ، تجارت گوسفند و بز در جهان بیشتر از سایر دامهای اهلی می باشد که در مقایسه با گوسفند وبز تطابق پذیری کمتری دارند . بیماری شبیه آبله بزی در غرب ایالات متحده گزاش شده ولی تلاشی درجهت تعین عامل بیماری بعمل نیامده. موارد جدید بیماری در آذربایجان ومغولستان نیز گزارش شده .
روند بیماری زائی:
ویروس های آبله بسته به نوع و سویه ویروس و گونه میزبانی ،می توانند یک عفونت موضعی و بخودی خود محدود شونده ای را ایجاد کرده و یا اینکه سبب یک عفونت سامانه ای پر آشوب و ملتهب گردند .تصور بر این است که بسیاری از تاثیرات ویروسی بر یاخته میزبان مبتنی بر اثرات ژنتیکی است .ممکن است برخی از این تغییرات اعمال شده در سوخت و ساز یاخته ای برای روند تکثیر ویروس ضروری باشد. برخی نیز ممکن است به سادگی روندهای تکثیر ویروس را بهینه نموده یا در طی عفونت یاخته های معینی (طیف میزبانی) مورد نیاز باشند و یا به منظور محافظت ویروس از سازوکارهای دفاعی میزبان عمل نمایند . بعنوان مثال برخی از ویروسهای آبله دارای ژن رمزگذاری هستند که محصولات آن تشابه اسید امینه ای قابل توجهی با عامل رشد اپیدرمی (EGF) وعامل مبدل رشدی آلفا (TGF-α) [23] دارند . پروتئین حاصل از ژن فوق در ویروس واکسینا VGF[24] نامیده می شود .این عامل یک پروتئین ترشحی ،گلیکوزیله شده 22 تا 26 کیلودالتونی است . بررسی ها نشان می دهد که این پروتئین (VGF) برای اتصال با گیرنده های EGF موجود در سطح یاخته با خود EGF در رقابت می باشد . و از طرفی VGF با باقی مانده های تیروزینی در گیرنده های EGF واکنش فسفوریلاسیون داشته و در برخی از یاخته ها نیز اثر میتوژنی دارد. در واقع می توان گفت که VGF دارای دو وظیفه در روند تکثیر ویروسی است ، نخست اینکه شکل غشائی VGF موجب اتصال ذرات ویروسی به یاخته های پوشیده از گیرنده های EGF می شود و دیگر اینکه شکل ترشحی VGF فعالیت رشد و سوخت و سازی یاخته های غیر آلوده به ویروس را تحریک می نماید تا در نتیجه این رخداد روند انتشار ویروس تسهیل گردد .
با انتقال ویروس از مسیر های گوناگون که در بحث همه گیرشناسی عنوان شد، ویروس وارد بافت های زیر جلدی یا مخاطی اندامهای تحت تهاجم می شود . در بافت های مخاطی و زیر جلدی ویروس یاخته های بیگانه خوار و لنفوسیت های حاضر را تحت تهاجم قرار می دهد . درصورت عدم وجوت ایمنیت قبلی تکثیرویروسی در یاخته های آلوده محقق شده و از طریق مجاری لنفی خود را به غدد لنفاوی موضعی می رساند . تکثیر اولیه ویروس در غدد لنفاوی متعاقب است با ورود به جریان خونی و ظهور ویرمی اولیه. همانند دیگرآلودگی های ویروسی بروز لوکوپنی از تظاهرات خونی این ویروس می باشد که خود ناشی از تاثیر کشندگی ویروس بر گویچه های سفید خونی است . برای بروز بیماری بصورت شدید و گسترده و به گونه ای که منجر به مرگ دام گردد ، ویروس آبله بایستی در بافت های خاصی به بیشینه میزان عفونت زائی خود برسد. کبد و طحال اندام های هستند که در این راستا ایفای نقش می کنند . با بروز ویرمی اولیه و ورود ویشه های ویروسی به طحال ، لنفوسیت های طحالی آلوده شده و روند تکثیر ویروسی را بطور کامل پشتیبانی می کنند. ولی در کبد روندآلودگی به گونه ای دیگر است . اساساً یاخته های پارانشیمی کبد توسط مجموعه ای از یاخته های خاص احاطه شده اند که به آنها یاخته های کرانه ای(ساحلی)[25] می گویند . این یاخته ها عبارتند از یاخته های کوپفر ، یاخته های اندوتلیال و دیگر گویچه های سفید خونی . ویروس آبله برای آلودن یاخته های پارانشیمی کبد ایستی ابتداعاً از این سد عملیاتی کامل متشکل از یاخته های کرانه ای عبور نماید .در آغاز ورود ویروس به کبد 99٪ از ویشه های ویروسی توسط این نوع یاخته ها جذب شده و بخش اعظم آن در عرض یک ساعت غیر فعال می شوند. ولی در حدود ثلث یاخته های کرانه ای به روند تکثیر ویروس کمک کرده و در حدود 10 ساعت پس از عفونت اولیه ویروس وارد یاخته های پارانشیمی کبد می گردد . در طی 2 تا 3 روز اول عفونت پیش از ایجاد کمپلکس سازگار نسجی محدود(MCH) با پاسخ ایمنی CTL به ویروس ، فعالیت غیر اختصاصی مرگ یاخته ای را می توان در مورد یاخته های آلوده به ویروس آبله مشاهده نمود . لنفوسیت های دانه دار بزرگ یاخته های عاملی هستند که روند تجزیه و تخریب یاخته های آلوده به ویروس را در فقدان حضور پادتن های ضد ویروسی اعمال می نمایند ، به این نوع لنفوسیت ها یاخته های قاتل طبیعی (NK-cell) [26]می گویند. این یاخته ها در اثر اینترفرون ها فعال شده و درصورت تماس با اینترلوکین نوع دوم (IL-2) متعاقباً اینترفرون گاما )ץ(INF- را تولید می کنند. به محض آلودگی میزبان با ویروس یک پاسخ التهابی معمول با هجوم لوکوسیت ها پدیدار می گردد که بدنبال آن با تولید اینترفرون ، یاخته های NK فعال شده و سرآنجام یاخته های آلوده میزبان بعنوان هدف توسط NK تجزیه و تخریب می گردند . پیش از بروز پاسخ های ایمنی می توان روند التهاب را بصورت ضایعات حاصل از ویروس آبله (مانند ویروس واکسینا) مشاهده نمود،البته در برخی از سویه ها این ضایعات دیده نمی شوند. التهاب با ورود ویروس به ناحیه درمی پوست به صورت سرخ شدگی ناشی از بسط عروقی و احتقان تظاهر می نماید. تهاجم ونفوذ نوتروفیل های چند هسته ای ( PMNs ) [27] در آغاز عفونت و سپس یاخته های بیگانه خوارتک هسته ای تا 24 ساعت پس از آن محقق شده و تا روز سوم به اوج خود می رسد . با یورش یاخته های بیگانه خوار به موضع آلودگی و افزایش غلظت مواد شیمیائی جاذب[28] مترشحه از1) یاخته های آلوده به ویروس 2) یاخته های بیگانه خوار و3) واکنش های عروقی، لوکوسیت ها به ناحیه غنی از این مواد جاذب حرکت می کنند .حداقل سه دسته مواد واسطه التهابی از این سه منبع ذکر شده ترشح می گردد: الف)آمین های بسط عروقی دهنده،پروتئین های کاتیونیک و پروتئازها ب) محصولات زیستی فعال حاصل از سامانه کینین(مانند برادیکینین) ،سامانه کمپلمانی (مانند C5a) و سامانه انعقادی(مانند فیبرینوپپتیدها) پ) ترکیبات اوتوکوئید[29] لیپیدی مانند ایکوزانوئید ها و عوامل فعال کننده پلاکتی. این امکان نیز وجود دارد که بعد ها در طی عفونت و با گسترش یک پاسخ ایمنی گروه خاصی از لنفوسیت ای تیموسی (TDTH) به ناحیه ضایعه دیده مهاجرت کرده ومواد شیمیائی جاذب و فعال کننده دیگری را ترشح نمایند که روند ورود یاخته های التهابی به آن موضع را تحریک می کند.این واکنش ازدیاد حساسیت تاخیری( DTH) در غالب آلودگی های آبله ای دیده می شود. درحدود روز 3تا5 پس از تلقیح تعداد نوتروفیل های چند هسته ای ، یاخته های تک هسته ای، لنفوسیت ها و فیبروبلاست ها افزایش می یابد . این پاسخ التهابی به عفونت همراه با نکروز می باشد . بررسی ها نشان داده که حضور یاخته های التهابی در ضایعات آبله ای دارای یکسری ویژگی هائی است که ممکن است عملاً انتشار ویروس را محدود سازد . این ویژگی ها عبارتند از :
1) تولید محصولات ضد میکروبی وابسته به اکسیژن.
2) تولید محصولات ضد میکروبی مستقل از اکسیژن .
3) بیگانه خواری با واسطه گیرنده های Fc و جزء C3b کمپلمانی که متعاقب است با عمل ویروس کشی .
4) ترشح اینترفرون ها و لنفوکین ها ئی که جمعیت سلولی مضاعفی را به موضع جذب می کنند .
نوتروفیل ها و یاخته های بیگانه خوار ظاهراً ویروس های پوشیده از پادتن را بدنبال عمل بیگانه خواری تخریب می کنند ولی این امکان نیز وجود دارد که ویروس ها در داخل این یاخته ها نیز تکثیر یافته و در صورت عدم تخریب ویروس خود این یاخته های بیگانه خوار منجر به انتشار ویروس در میزبان آلوده شوند . بعنوان مثال بررسی ها در ویروس Ectromelia نشان می دهد که انتشار ویروس در بدن میزبان (کبد و طحال) توسط منوسیت ها و دیگر لوکوسیت ها و از طریق جریان خونی محقق می گردد. در ویروس آبله بدلیل حضور نوعی پروتئین 38 کیلودالتونی شبه سرپینی بروز این نوع پاسخ های ایمنی اولیه با تهاجم نوتروفیل ها و بیگانه خوارها به موضع مهار شده و ویروس امکان تکثیر و انتشار می یابد .اگر چه تاثیر پاسخ های التهابی با تولید اینترفرن ها در کاهش میزان تکثیر ویروس آبله در ضایعات اولیه قابل توجه است ولی علارغم این واقعیت ویروس قادر است پس از انتشار ارگانهای داخلی(کبد و طحال) را آلوده نماید . این رخداد چنین نتیجه گیری را ارائه می کند که پاسخ های التهابی گسترده در مقابل عفونت اولیه برای پاکسازی ویروس کافی نبوده و لازمه تحقق آن وجود پاسخ های ایمنی اکتسابی است . بررسی های اخیر نشان داده که روند های التهابی به همراه یاخته های تیموسی ایمنی پیشرفت بیماری را کند کرده و موجب پاکسازی عفونت ویروسی می گردد. در حالت کلی می توان گفت که همراهی پاسخ های التهابی با پاسخ های ایمنی اضافی از ضروریات روند بهبودی بیماردر مرحله ای است که عفونت سامانه ای اولیه با ویروس های آبله ای پدیدار گردیده. پاسخ های اکتسابی یا ایمنی در برابر ویروس های آبله مجموعه ای از واکنش های سلولی هستند که منجر به تولید پادتن های ضد ویروسی اختصاصی توسط لنفوسیت های بورسی(B-Cell) شده و از طرفی نیز موجب بروز واکنش ازدیاد حساسیت (DTH) مختص ویروس و پاسخ های مرگ یاخته ای توسط(T-Cell) لنفوسیت های تیموسی می گردد. پادتن های اختصاصی قادرند بطور مستقیم با اجزای ویروس واکنش داشته و این واکنش خود می تواند با یا بدون حضور کمپلمان تحقق یابد و یا ممکن است که پادتن ها ی اختصاصی از طریق گیرنده های FC به سطح نوعی از لوکوسیت ها (یاخته های نوع K ) چسبیده و این یاخته را با واکنش اختصاصی در مقابل ویروس آبله مسلح نماید(ADCC) . پادتن های ضد ویروسی اختصاصی قادرند بواسطه سازوکار های متنوعی انتشار ویروس های آبله در بدن میزبان را کاهش دهند . این سازو کار ها عبارتند از :
1) ممانعت از اتصال ویروس به سطح یاخته میزبان بواسطه پوشاندن گیرنده های اتصالی ویروس به یاخته .
2) ایجاد تجمع توده ای در ویروس (Aggregation) .
3) ممانعت از دخول ویروس در یاخته .
4) ممانعت از پوشش زدائی ویروس .
5) افزایش بلع ویروسی توسط یاخته های بیگانه خوار از طریق گیرنده های Fc (اتصال پادتنی)
6) افزایش تجزیه و تخریب ویروسی یا لیز سلولی یاخته های آلوده به ویروس با کمک کمپلمان یا روند مرگ یاخته ای وابسطه به پادتن با واسطه سلولی (ADCC) .
علارغم اعمال سازو کار های فوق بررسی ها نشان می دهد که سازوکار های ضد ویروسی با واسطه پادتنی در جهت حفاظت ایمونولوژیک یک میزبان حساس از عفونت اولیه ویروسی توسط یک ویروس حاد آبله کافی نمی باشد.
بطور کلی پاسخ های میزبانی به عفونت آبله ای متفاوت و پیشرونده بوده و کاملاً بستگی به گونه ویروس و میزبان دارد. بعنوان مثال در عفونت ویروسی ectromelia در موش روند بهبودی همگرائی زیادی با میزان تشکیل لنفوسیت های تیموسی قاتل (CTL) دارد . ولی به هر حال در عفونت با ویروس واکسینا بطور معمول لنفوسیت های تیموسی قاتل قابل مشاهده نبوده و فعالیت مرگ یاخته ای با واسطه سلولی ظاهراً به همراه ADCC و یاخته های قاتل طبیعی (NK-Cell) محقق می شود . پاسخ های اولیه به عفونت غیر اختصاصی است و شامل تولید موضعی اینترفرون ، احتمالاً فعال شدن مسیر آلترناتیو کمپلمان ، التهاب و یاخته های قاتل طبیعی می باشد . هیچ کدام از این پاسخ های اولیه به ظاهر و به تنهائی برای پاکسازی ویروس از میزبان کافی نیستند . بدنبال این پاسخ های اولیه غیر اختصاصی پاسخ های اکتسابی پدیدار می شوند . بطور کلی این پاسخ ها شامل روند تولید پادتن های ضد ویروسی اختصاصی توسط لنفوسیت ها نوع بورسی و ازدیاد حساسیت تاخیری (DTH) مختص ویروس و پاسخ های مرگ یاخته ای توسط لنفوسیت های تیموسی است . به نظر می رسد که تولید پادتن ها در پیش گیری از عفونت مجدد حائز اهمیت باشد . مهمترین نوع پاسخ های میزبانی در برابر عفونت ویروس آبله ظاهراً پاسخ های التهابی به همراه ازدیاد حساسیت تاخیری و تولید لنفوسیت های تیموسی قاتل با واسطه لنفوسیتی است .
توانمندی ویروس در تکثیر داخل یاخته ای برای سویه های مختلف ویروسی متفاوت است . این پدیده خود ناشی از تفاوت های ژنتیکی در ویروس های فوق می باشد . اساساً با ورود ویروس آبله به یاخته میزبان و بیان ژنی اولیه روند تولید پروتئین های ویروسی و یاخته میزبان با سنتز محصولات معینی مهار می گردد. بنا بر این عفونت ویروسی در مرحله اول عقیم مانده و منجر به مرگ یاخته آلوده می شود (اثر کشندگی ویروس) . ولی در سویه های حاد و بیماری زا قابلیت تکثیر ویروس در یاخته آلوده و ادامه روند تولید پروتئین های ویروسی تداوم می یابد . بررسی ها نشان می دهد که بعنوان مثال در ویروس آبله گاوی ناحیه ژنومی معینی که بصورت توالی ژنی kbp 3/2 حاوی قالب باز شده DNA در حال ترجمه است (ORF) ، دارای رمز یک پلی پپتید 77کیلودالتونی است . این پلی پپتید بصورت مستقیم یا غیر مستقیم امکان روند ترجمه مستمر ژنوم ویروسی و تولید mRNA را برای یاخته آلوده محقق می سازد . در نتیجه علارغم اینکه در یاخته های پارانشیمی کبد و لنفوسیتی طحال روند تولید پروتئین های میزبانی متوقف شده ولی کماکان روند تکثیر و تولید پروتئین های ویروسی تداوم می یابد . بررسی های اخیر نشان می دهد که یک واحد تکراری آنکیرین [30] در این پلی پپتید حضور دارد . آنکیرین ها واکنش های مابین پروتئین های یکپارچه کننده غشایی[31] و اجزای اسکلتی یاخته [32] را کنترل می کنند . مثال دیگر از ژن های دخیل در ادامه روند تکثیر داخل یاخته ای ORFK1L از ژنوم سویه کپنهاگ است که یک پلی پپتید 29 کیلودالتونی را رمز گذاری می کند . این پلی پپتید که در ابتدای عفونت تولید می گردد و ادامه روند تکثیر ویروسی را ممکن می سازد . در واقع این ژن در تثبیت روند تولید پروتئین های ویروس ایفای نقش می نماید . اخیراً ژن سومی نیز در سویه کپنهاگ به نام ORFC7L مشخص شده که با تولید پروتئین 29 کیلودالتونی به ادمه روند تکثیر پروتئین های ویروسی کمک می نماید.
تفاوتهای ژنتیکی سویه های مختلف ویروس آبله نه تنها بر توانمندی تکثیر ویروسی در یاخته اثر گذار است بلکه همچنین نوع یاخته هدف جهت تکثیر را نیز تعین می کند ، بعنوان مثال ویروس MCV [33]گرایش بافتی بسیار محدودی دارد ، و تنها در یاخته های پوششی انسان تکثیر می یابد . پدیده فوق نیز ناشی از این واقعیت است که تکثیر بارور ویروس MCV در یاخته های پوششی نیازمند تولید عامل یا عاملینی است که توسط یاخته های پوششی پوست انسان حاصل می شوند و از طرفی ویروس MCV فاقد اطلاعات ژنتیکی است که ویروس را در داشتن طیف گسترده ای از یاخته های میزبان محدود می نماید .
بطور خلاصه می توان گفت که حداقل سه ژن ویروسی معین در روند تکیر ویروسی در انواع یاخته های میزبانی ایفای نقش می کنند که به احتمال زیاد این ژن ها در تمایل ویروس به بافتهای مختلف حائز اهمیت هستند . و از طرفی عفونت های عقیم ویروس های آبله که منجر به مرگ یاخته می شوند در تظاهرات بیماری نیز ایفای نقش می کنند . ویروس های آبله موجب بروز اثرات سمی در یاخته های آلوده می گردند، این اثرات عبارتند از گرد شدگی[34] ، دانه دار شدن [35]و تشکیل خوشه[36] در تعدادی از یاخته ها . گردشدن یاخته ای تنها در انواع معینی محقق می گردد و لازمه آن تولید پروتئین های مرحله اول است . این رخداد با ایجاد وقفه در روند تولید پروتئین توسط ماشین رونوشت برداری یاخته ای بطور برگشت ناپذیر و حتی در صورت حضور mRNA ویروسی متوقف می شود . همچنانکه روند عفونت پیشرفت می کند ساختار مهندسی یاخته آلوده رو به زوال گذاشته و همزمان با آن ویروپلاسم و سپس اجسام گنجیدگی نوع A (ATIs) ظاهر می گردند . طی مراحل نهائی چرخه عفونت ویروس (ویروس های معین) در نتیجه همجوشی بین یاخته ای پلی کاریوسیت ها[37] تشکیل می شوند . در ویروس های آبله ای که دارای هماآگلوتینین باشند رخداد فوق کمتر محقق می شود . یکی دیگر از ویژگی های ویروس های آبله تشکیل واکوئل های سیتوپلاسمی در داخل یاخته های آلوده است . غشای یاخته های آلوده حداقل در سه مرحله از روند عفونت ویروسی دستخوش تغییراتی می شوند. در ابتدا و درطی مرحله نفوذ ، پادگن های ویشه ویروسی بدنبال همجوشی غشای بیرونی یا پوشش ویروس با غشای پلاسمائی یاخته در آن جای گزین می شوند . بررسی ها نشان می دهد که این در آمیختگی غشائی به منظور تحریک و برانگیختن لنفوسیت های تیموسی قاتل (CTL) [38] از یاخته های خاطره ای اولیه ویروسی و ایجاد تغییرات ساختاری لازم جهت تبدیل این یاخته به یک یاخته هدف برای لنفوسیت های تیموسی قاتل ، کافی می باشد . در مرحله دوم که به لحاظ فیزولوژیک آشکار تر است تغییرات غشای پلاسمائی یاخته ابتداعاً پس از یک عفونت با تعداد و کثرت کم (با MOI پائین) ظاهر می گردد که خود ناشی از تولید پروتئین های اولیه ویروسی است . با ظهور شاخص های ویروسی در سطح یاخته ، لنفوسیت های تیموسی قاتل آنها را شناسائی می کنند که این رخداد خود ناشی از تولید پروتئین های اولیه ویروسی است. ادغام دو پلی پپتید اولیه مختص ویروس با جرم ملکولی 25 تا 27 کیلودالتون و 16 تا 17 کیلودالتون ، حساسیت یاخته آلوده برای تجزیه و تلاشی توسط لنفوسیت های تیموسی قاتل را افزایش می دهد . سر انجام پس از شروع تولید DNA ویروسی و تولید پروتئین های پایانی(اختتامی) تعدادی از این محصولات در سطح یاخته ظاهر می شوند (مانند هم آگلوتینین) . هنوز نقش محصولات پایانی ویروس در تحریک CTL و عملکرد آنها بدرستی معلوم نیست ولی شواهدی وجود دارد حاکی از اینکه در شرایط خاص پروتئین های پایانی ناشی از عفونت ویروسی توسط لنفوسیت های تیموسی قاتل مختص ویروس شناخته نمی شوند . در ساعات اولیه عفونت غشای یاخته میزبان دست خوش تغییراتی در میزان نفوذ پذیری غشائی شده و یکپارچگی غشای پلاسمائی رو بزوال می گذارد .
همچنانکه عنوان شد ورود ویروس به داخل یاخته میزبان و شروع چرخه تکثیر ویروسی متعاقب است با رخداد هائی که بر سوخت وساز میزبان اثر مهاری دارد . این تاثیرات مهاری بسته به انواع ویروس های آبله و یاخته ها متفاوت می باشد . بعنوان مثال ویروس Yaba موجب تشکیل غدد سرطانی (تومور) شده و یاخته های آلوده را وادار به تکثیر مستمر می نماید . در این یاخته های آلوده تولید پروتئین های میزبانی خاصی افزایش می یابد . در مقابل این گونه تاثیر، سویه های ویروسی دیگری همچون ویروس آبله میمون ، ویروس واریولا ، ویروس آبله گاوی و ویروس واکسینا در طی روند عفونت به سرعت موجب توقف تولید پروتئین ها می شوند . در حالت کلی اورتوپاکس ویروس ها روند تولید پروتئین های میزبانی را بطور مستقیم مهار می کنند و سینتیک این روندهای مهاری به میزان زیادی با توجه به وضعیت عفونت همچون تعدد و کثرت عفونت (MOI) و نوع یاخته میزبانی متغییر است . سازو کارهای متعددی برای توجیه این مهار روند ترجمه پیشنهاد شده که عبارتند از :
1) یک فرآوری نسبتاً خالص از اجزای موئینه سطحی (STE) تنها موجب مهار تولید پروتئین های میزانی می شود که این امر احتمالاً در مرحله آغازین روند تکثیر زنجیره پلی پپتیدی صورت می گیرد .
2) یک پروتئین پایه ای 11 کیلو دالتونی کاملاً خالص شده که از بخش مغزی ویشه ویروسی بدست آمده موجب مهار تولید پروتئین در سامانه تولید پروتئینی رتیکولوسیتی در محیط آزمایشی می گردد. به نظر می رسد که این پروتئین 11 کیلودالتونی تشکیل مجموعه آغازین تحت واحد S40 ریبوزومی با Met-tRNA را مسدود می سازد . این پروتئین بطور یکسان در مهار ترجمه mRNA ویروسی و میزبانی اثر گذار است .
3) تولید ملکول های کوچک پلی (A) حاوی RNA در محیط زنده بدن جاندار (invivo) با مهار سریع روند تولید ملکول های درشت پیکر میزبانی همگرائی دارد . بررسی ها نشان می دهد که پلی (A) حاوی RNA که بطور صناعی تولید شده و یا از بخش مغزی ویروس بدست آمده وقتی با سامانه تولید پروتئین رتیکولوسیتی آزمایشگاهی اضافه می گردد ، بطور انتخابی ترجمه mRNA با منشاء میزبانی را در مقایسه با ویروس واکسینا مهار می نماید .
4) دو مطالعه مستقل سینتیکی این فرض را مطرح می سازد که ویروس واکسینا علاوه بر مهار آغازین روند تولید پروتئین ، سرعت طویل شدگی زنجیره پلی پپتیدی را نیز کاهش می دهد .
در حالت کلی می توان نتیجه گرفت که روند های اصلی تولید زیستی میزبانی درطی عفونت ویروسی مهار می شوند. و سازو کار های مختلفی را می توان در این روند مهاری تولید پروتئین های میزبانی دخیل دانست .
از دیگر اثرات مهاری بر روند سوخت وسازی یاخته میزبان توقف تولید DNA است . ویروس های آبله تولید DNA هسته ای میزبان را مهار می کنند . بررسی ها نشان می دهد که اجزای ویشه ویروس- احتمالاً یک اندونوکلئاز- از طریق هیدرولیز نمودن DNA در حال تشکیل میزبان در این روند مهاری ایفای نقش می نماید . همچنین بدلیل اینکه روند تولید DNA یاخته میزبان توسط ترکیبات مهار کننده تولید پروتئین متوقف می شود ، تصور بر این است که این وقفه در تولید پروتئین های میزبانی توسط ویروس بطور غیر مستقیم موجب ایست تولید DNA در یاخته آلوده به ویروس می گردد .
از دیگر اثرات درون یاخته ای ویروس آبله مهار تولید و یا فرآوری RNA میزبانی است که در یاخته های آلوده به ویروس واکسینا به سرعت قابل مشاهده است . لازمه وقوع این روند مهاری، حضور ویروس زنده می باشد و از طرفی این تاثیر مستقل از تعدد وکثرت عفونت(MOI)[39] است.همچنین این اثر مهاری لزوماً در مرحله ای از چرخه ویروسی تحقق می یابد که هدایت تولید پروتئینی در کنترل ویروس است . سازوکارهای این مهار تولید RNA میزبانی به نظر می رسد که مربوط به فعالیت RNA پلیمراز نوع دوم و نیم عمر mRNA باشد . روشن شده که فعالیت RNA پلیمراز نوع دوم هسته ای پس ازعفونت ویروسی کاهش می یابد ، بطوری که یاخته آلوده به ویروس آبله از رونویسی ژنهای تحت کنترل پیشتاز های RNA پلی مراز نوع دوم عاجز بوده اما روند رونوشت برداری ژنهای تحت اثر RNA پلمراز نوع سوم کماکان ادامه می یابد . بدنبال عفونت با ویروس واکسینا نیم عمر توده mRNA میزبانی بطور پیش رونده ای کاهش می یابد .
جدا از اثر مهاری ویروس بر سوخت وساز یاخته ای با ورود ویروس به داخل یاخته میزبان روندهای مهاری در مقابل سامانه دفاعی بدن حیوان نیز پدیدار می شوند . اساساً حیوانات میزبان محیط نامناسبی برای تکثیر ویروس های آبله به شمار می آیند . ابعاد نسبتاً بزرگ این ویروس های بیماری زا به روند پاکسازی یاخته های بیگانه خوار سامانه رتیکولواندوتلیال (سامانه بیگا نه خواری تک هسته ای) کمک می نماید . تغییرات اولیه غشای پلاسمائی یاخته های میزبان توسط پلی پپتید های مختص ویروسی راهی را برای تحقق روند مرگ یاخته ای[40] وابسته به پادگن با واسطه سلولی (ADCC)[41] فراهم می سازد . و یا اینکه با واسطه لنفوسیت های تیموسی قاتل یاخته های آلوده به ویروس پیش از تولید ویروس های بارور از بین می روند .
ناتوانی ظاهری ژنوم ویروس های آبله برای یک حضور پایدار در یاخته میزبان از ابقاء ویروس ها با حالتی پنهان در حیوانات آلوده ممانعت بعمل می آورد . علارغم این واقعیت ویروس های آبله عوامل بیماری زای حیوانی موفقی هستند . این موفقیت احتمالاً ناشی از توانمندی عملکردی ویروس در جهت رشد بوده که با سازوکار های دفاعی میزبان در تقابل است . توانمندی عملکردی ویروس های آبله به جهت وجود عواملی است که توسط ویروس تولید می شوند ، یکی از این عوامل ترکیبات مهارکننده پروتئازهای سرینی می باشدکه به اختصار سرپین (SERPINs)[42]نامیده می شوند. سرپین ها متعلق به خانواده ای از پروتئین های مرتبط هستند که بر رخداد های مربوط به تغییر و تبدیل بافت همبندی ، انعقاد ، تجزیه فیبرین ، فعالیت کمپلمان و واکنش های التهابی اثر کنترلی دارند . ترکیبات این خانواده در ساختار کروی ، فشرده شده ، بسیار منظم و با ظاهری که در آن مرکز انفعالی بصورت یک حلقه بر روی سطح خارجی ملکول قرار گرفته مشترک می باشند . این بخش حلقوی انفعالی تقلید کننده سوبسترای پروتئازها با شاخص های ویژه ای در قسمت باقیمانده P1 می باشد بطوری که معمولاً بعد از باقی مانده P1′ قرار می گیرد و معمولاً (نه در تمامی موارد) یک سرین است . این سرپین های پروتئولیتیک در نسبت 1:1 با پروتئازها ی سرینی خاصی پیوند یافته و موجب شکافت و تشکیل مجموعه ای می شوند که به سرعت از جریان خونی پاکسازی می گردد.
مقایسه توالی پروتئینی مهار کننده نوع دوم فعال ساز پلاسمینوژن (PAI-2) از خانواده سرپین ها
با توالی اسید های آمینه دیکته شده توسط ORF مربوط ویروس های آبله .
از دیگر عوامل موثر در توانمندی عملکردی ویروس های آبله پروتئین ترشحی 35 کیلودالتونی است که تشابهی ساختاری با یک فوق خانواده پروتئینی از اوکاریوت ها دارد ، این خانواده حداقل دارای شش پروتئین کنترل کننده کمپلمانی است . پروتئین 35 کیلودالتونی یاد شده بیشترین میزان تشابه توالی اسید های امینه ای را با پروتئینی دارد که با جزء C4b کمپلمان پیوند می یاد، در ویروس واکسینا از این پروتئین 35 کیلودالتونی تحت عنوان پروتئین متصل به کمپلمان ویروس واکسینا (VCBP) [43]یاد می شود . این پروتئین 35 کیلودالتونی بطور مستمر در طی عفونت ترشح می شود و با اتصال به جزء C4b کمپلمانی موجب توقف مسیر کلاسیک می شود و با توقف این مسیر، تاثیر مخرب آبشار کمپلمانی بر ویروس های آبله مسدود می گردد. درصورت مهار موثر VCBP آبشار کمپلمانی از طریق مسیر کلاسیک با واسطه پادتنی محقق می گردد . بنابر این در عفونت های آبله ای وجود این پروتئین امکان تاثیر پادتن ها ی ضد آبله ای را بی اهمیت می کند .اثرمهاری پادتن ها بر روند عفونت ویروس آبله در مراحل مختلفی اعمال می شود که عبارتند از : مرحله اتصال ویروس به یاخته میزبان ، مرحله نفوذی و مرحله پوشش زدائی . هر دو ویژگی خنثی سازی و غیر فعال سازی ویروس های آبله توسط پادتن با حضور کمپلمان تشدید می گردد. بطور کلی می توان گفت که پادتن های اختصاصی ویروس های آبله در روند بهبودی عفونت اولیه بی اهمیت بوده ولی این پادتن ها در پیش گیری از عفونت مجدد حائز اهمیت هستند .
ویروس های آبله ای دارای ویژگی ضد اینترفرونی هستند . اصولاً در یاخته های تحت تاثیر اینترفرون سه نوع آنزیم تولید می شود : 1) اندوریبونوکلئاز(Endoribonuclease) 2)2′ , 5′ A سنتتاز و 3) پروتئین کیناز . محصولی از ′2،′5 اولیگوایزوآدنیلات سنتاز موجب فعال شدن اندوریبونوکلئاز می شود که این محصول نیز خود موجب افزایش تخریب و تلاشی mRNA ویروس می گردد. ویروس های آبله(مانند واکسینا) در اثر تولیدات اولیه ژنی موجب مهار فعالیت کینازی می گردند و در نتیجه روند مهاری با واسطه اینترفرون متوقف می شود .
از دیگر ویژگی های ویروس های آبله (مانند ویروس میکسوما) سرکوب شدید سامانه ایمنی است . این تاثیر خود ناشی از آلودگی جمعیت لنفوسیتی نوع تیموسی و بورسی به ویروس بوده (اولیه) و یا اینکه در اثر عامل سرکوبگر محلول ، غیر اختصاصی است (ثانویه) که با تحریک ویروس آبله از لنفوسیتهای تیموسی ترشح می گردد .
سازو کار دیگری که ویروس آبله جهت مقابله با سامانه دفاعی میزبان دارد مربوط به فعالیت ترکیبات کیموکین است. کیموکین ها در واقع سیتوکین های جاذب شیمیائی می باشند که تردد و توانمندی عملکردی لوکوسیت ها را تنظیم می نمایند . کیموکین ها با گیرنده های اختصاصی خود و گلیکوزآمینوگلیکان های سطحی یاخته از طریق جایگاه های پیوندی مجزائی واکنش دارند . اتصال کیموکین به گیرنده اختصاصی خود راهی است برای ارسال پیام های زیستی ، در حالی که ایجاد اتصال با گلیکوزآمینوگلیکان درایجاد اجزای کیموکینی جاذب شیمیائی ثابت که موجب عبور یاخته های ایمنی از پوشش اندوتلیالی تک لایه ای و رسیدن به بافت ها می شود، حائز اهمیت می باشد .ویروس هاس آبله دارای سه سازوکار متفاوت جهت مسدود نمودن این فعالیت کیموکینی هستند.
1) ویروس آبله نوعی پروتئین مشابه کیموکین تولید می کند که با فعالیت آنتاکونیستی اثر کیموکین ها را خنثی می نماید .
2) ویروس آبله تولید پروتئین متصل به کیموکین نوع یک (vCKBP-1) ، یک گیرنده اینترفرون گاما(RץvINF-) می کند که از واکنش کیموکین ها با گلیکوزآمینوگلیکان ها وجای گیری درست آن در جایگاه اتصال با گلیکوزآمینوگلیکان ممانعت بعمل می آورد .
3) ویروس آبله با تولید پروتئین متصل به کیموکین نوع دو (vCKBP-2) که نوعی پروتئین ترشحی است واکنش بین کیموکین ها و گیرنده های اختصاصی کیموکینی را مهار کرده واز این رو انگیزش فعالیت زیستی آنها را متوقف می سازد .
خلاصه سازوکار های مربوط به مهار کیموکینی
بنا براین ویروس حاد آبله بواسطه عوامل یاد شده توانمندی مقابله با انواع امکانات دفاعی بدن حیوان را داشته و از این راه به تکثیر و گسترش در بدن میزبان ادامه می دهد . پس از تکثیر ویروس در یاخته های پارانشیمی کبد ولنفوسیت های طحال ، ویروس بیشینه عفونت زائی را بدست آورده و مجدداً وارد گردش خونی شده و ویرمی ثانویه شکل می گیرد . این عمومی شدن عفونت متعاقب است با تهاجم ویروس به بافت های پوششی و بروز ضایعات جلدی و جوش های مربوط به آبله .
نشانه های بالینی:
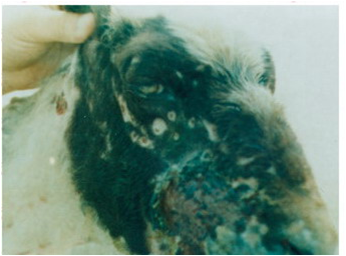
اساساً یک تشخیص قطعی در خصوص آبله بزی و گوسفندی بر مبنای سیمای بالینی ، آسیب شناختی و همه گیر شناسی بیماری استوار است . بیماری در تحت شرایط میدانی (انتشار طبیعی) دارای دوره نهفته ای بین 4 تا 21 روز(معمولاً 1 تا 2 هفته) است . آلودگی بطور تجربی با ظهور اولین نشانه بالینی (تب) 3تا 5 روز پس از تلقیح ویروس نمایان می گردد. عموماً نشانه های بالینی به هنگام تلقیح ویروس توسط حشره سریع تر از انتقال با ذرات معلق تظاهر می نمایند و پس از تلقیح جلدی ویروس ، ضایعات اولیه 2 تا 4 روز بعد در محل تلقیح نمایان می شوند. معمولاً دوره بیماری 4 تا 6 هفته بوده که در طی آن ضایعات آبله ای بطور مرحله ای ظاهر می شوند . بهبودی کامل از بیماری ممکن است تا 3 ماه به درازا بکشد .
تشخیص گله ای بیماری در تحت شرایط طبیعی مبتنی بر نشانه های بالینی است که در پوست تظاهر می کنند ، بطوری که این ضایعات با ملامسه پوستی بصورت افزایش ضخامت پوستی سراسری ، تب پایا ، تورم غدد لنفاوی وغالباً پنومونی تظاهر می کند . تنگی نفس ، التهاب ملتحمه ، ترشحات بینی نیز ممکن است دیده شود .اگرچه آبله بزی و گوسفندی در دام های حساس وجه مشخصه ای دارد ولی در دامهای بومی منطقه به سختی قابل تشخیص هستند. میزان تلفات ممکن است تا 50 درصد در بالغین و 95 درصد در بره ها و بزغاله ها (زیر یک ماه) برسد .
بیماری بصورت بالینی یا تحت بالینی(عفونت های پنهان) بروز می کند . روند بیماری در گوسفند و بز یکسان است . در شکل بالینی شدت بیماری متفاوت است وبسته به سن دام ، نژاد دام و میزان ایمنیت بروز نشانه ها از شدید تا خفیف متغییر می باشند . گاهی بروز ناخوشی سریع بوده بطوری که در طی چند روز به مرگ دام منجر می شود. این شکل از بیماری را غالباً در بره ها می توان دید . اصلی ترین تظاهر در این شکل تب و فلجی است .در بالغین اولین نشانه ها ممکن است شامل تب ، افسردگی ، التهاب ملتحمه ، تراوش اشک والتهاب مخاط بینی باشد . در طی چند روزاز شروع نشانه های آغازین [44] ضایعات آبله ای در پوست ظاهر می شوند . این ضایعات آبله ای بصورت نقاط سرخ بر آمده(فورانی) برروی مخاطات چشم و بینی و بر روی نواحی عاری از پشم مشهود هستند .
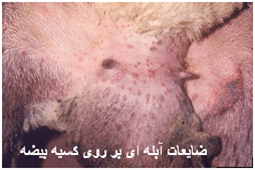
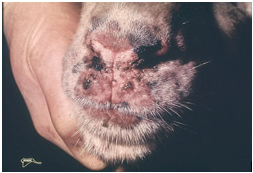
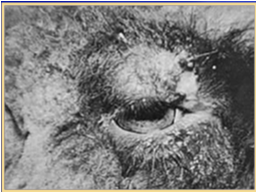
عموماً با شدت بیماری بر شدت و گسترش ضایعات افزوده می شود . ضایعات پوستی آبله ابتداعاً بصورت نواحی ملتهب گل انداخته ای[45] (ماکول) ظاهر می شوند . با پیشرفت ضایعه ناحیه ملتهب برآمده وبدرجاتی کم رنگ می شود بطوری که ضایعه بصورت ناحیه گل انداخته ای با مرکز بر آمده (جوش)تظاهر می کند.
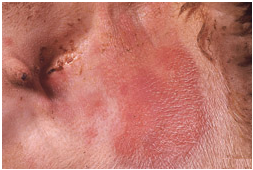

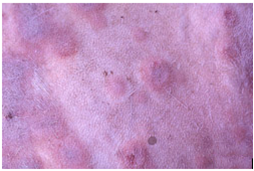
ضایعات آبله ای که دارای ترشح هستند وارد مرحله تاولی شده اند ، این شکل از ضایه ندرتاً بروز می نماید . عموماً پس از بروز جوش مرکز ضایعه بتریج تحلیل رفته و خاکستری (نکروزه) می شود ، در چنین مرحله ای این مرکز نکروزه توسط یک ناحیه پر خون احاطه می گردد . ترشح غلیظ زرد مایل به قرمزی از جوش ها خارج شده و دلمه زرد رنگی را بر روی ضایعه ایجاد می کند.
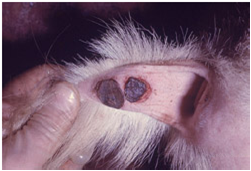

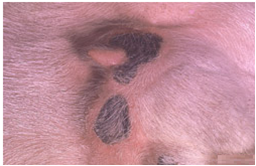
با ادامه روند بیماری (2 تا 4
هفته پس از اولین نشانه ها) ضایعات خشک شده و دلمه تشکیل می شود . شاخص ترین چهره
ضایعات آبله ای شامل حالتی است که تمامی ناحیه درم و اپی درم درگیر بوده و ضایعه
به بافت زیر جلدی نیز می رسد (شبیه گرهک). پس از بهبود ضایعات بسته به شدت ضایعه
پوستی ممکن است داغ زخم و ناحیه ای عاری از پشم و مو بر جای بماند . عفونت های
ثانویه نیز می توانند بر وخامت ضایعه
بیافزآیند . در گوسفندان مسن تر بیماری با نشانه های از ناخوشی جدی و افزایش قابل
توجه تب و کاهش اشتها آغاز می شود . جوش ها بر روی پرده های مخاطی بینی ، چشم ،
دهان و نواحی عاری از پشم (سطح داخلی ران و آرنج ، زیر شکم ، روی کیسه بیضه و
پستان) ظاهر می شوند . پوزه چنین گوسفندان و بز هائی متورم بوده و مخاط بینی و
دهانی ممکن است ضایعات گسترده ای داشته باشد .
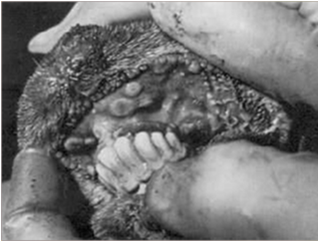
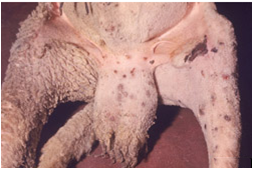
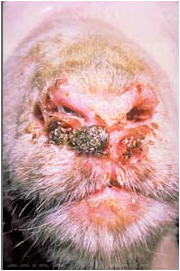
ولی به هر حال این جوش های سرخ ممکن است در نواحی دارای پشم نیز بروز نمایند . جوش های فوق در نواحی عاری از پشم ابتداعاً به شکل برآمدگی های کوچک که ممکن است رشد کرده و به قطر 10 میلیمتر برسند دیده می شوند . جوش های بزرگ تر سطح پهن داشته و پوست پیرامون قاعده آنها سرخ است. با عمومی شدن جوش ها در سطح بدن دام تمامی غدد لنفاوی سطحی معمولاً متورم هستند این امر خصوصاً در غدد پیش کتفی مشهود می باشد . عموماً دراشکال تاولی جوشی[46] مرکز جوش تحلیل رفته ، خاکستری مایل به سفیدو نکروزه بوده و توسط یک ناحیه پر خون احاطه شده. گاهی دلمه های تیره ، سخت و تیزی بر روی ناحیه نکروزه دیده می شود . شکل تاولی ضایعات آبله ای را ممکن است در مراحل بینابینی مشاهده نمود ولی این شکل ندرتاً بروز می کند . یک شکل غیر عمومی از ضایعه نیز وجود دارد که بصورت گرهک تظاهر نموده و به آن هسته آبله ای [47] می گویند. در این شکل جوش به شکل گرهک تبدیل می شود.این گرهک ها نهایتاً نکروزه شده و از پوست جدا گشته و داغ زخم فاقد موئی را بجای می گذارند.
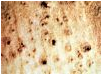
در برخی از نژاد های اروپائی بز ها ممکن است اشکال خون ریزی دهنده پهنی پدیدار گردد . در این اشکال به نظر می آید که جوش ها در سراسر بدن دام در هم ادغام شده اند . ضایعات آبله ای قادرند بر روی غشاهای اندام های داخلی نیز تشکیل شوند ، نتیجه این رخداد بروز نشانه های عمومی است . در مواردی که ضایعات در ریه تشکیل ایجاد شده باشند نشانه های تنفسی شامل سرفه، ترشحات بینی و تنگی نفس بروز می کند .بروز گرهک های آبله ای در روده ها موجب بروز اسهال می گردد. میش های آبستن مبتلا در غالب موارد دچار سقط می شوند .
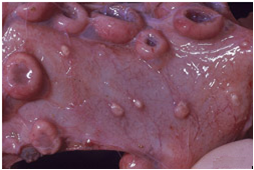

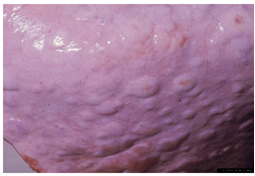
گوسفندان مبتلا اگرچه افسرده به نظر می رسند ولی ممکن است به خوردن ادامه داده تا اینکه بروز ضایعات دهانی مانع از این کار گردد . در بیشتر موارد پنومونی ، افسردگی ، بی اشتهائی و لاغری مفرط عمومی است و ممکن است تداوم داشته باشد . گاهی نشانه های عصبی نیز بروز می کند ولی ارتباط این نشانه ها با عفونت ویروس آبله ای هنوز بدرستی معلوم نیست . نشانه های بالینی در بره ها و بزغاله های مبتلا شدیدتر بوده و نشانه ها اشاره شده شدیدتر هستند بطوری که میزان تلفات را بالا می برند . عواملی چون آب و هوای نامساعد ، عفونت های انگلی ، تغذیه ضعیف و استرس میزان تلفات را بالا می برند .
خلاصه ای از نشانه های بالینی:
|
شکل تحت بالینی: - بصورت عفونت های پنهان در دام. |
|
اشکال بالینی با تظاهر ملایم تا شدید: - تب ، افسردگی ،افزایش سرعت تنفسی . - التهاب ملتحمه ، ترشح اشک ، التهاب مخاط بینی، تورم پلک ، نورگریزی. - برجستگی های فورانی پوستی با آغاز پیدایش نواحی ملتهب پوستی قابل توجه خصوصاً دربخش های فاقد مو یا عاری از پشم در بدن همچون میان دوراه ، ناحیه مغبنی ، کیسه بیضه ، پستان ، پوزه ، پلک ها و زیر بغل. - ضایعات به شکل جوش تبدیل می شوند. |
|
شکل تاولی جوشی: - جوش ها به رنگ سفید مایل به خاکستری درآمده ، پراکنده بوده و تشکیل دلمه هائی را می دهند که به راحتی کنده می شود . - ندرتاً جوش ها به شکل تاول کامل درآمده و پس از پاره شدن تاول دلمه ذخیمی آن را می پوشاند . |
|
شکل گرهکی(هسته آبله ای): - جوش ها بزرگ شده تا به گرهکی تبدیل شوند که تمامی لایه های پوستی و زیر پ.ستی را را در بر می گیرد. - بروز نکروز در گرهک منجر به کنده شدن ضایعه شده و داغ زخم فاقد موئی را برجای می گذارد. |
|
- در هر دو شکل گرهک هائی در ریه تشکیل می شود که موجب بروز برنکوپنومونی توام با سرفه، ترشحات فراوان از بینی ، افسردگی، بی اشتهائی و لاغری مفرط می گردد . |
|
- دامهای مبتلا ممکن است در طی 20 تا 30 روز بهبود یابند . |
|
- مرگ غالباً در مواقعی است که وضعیت بیماری پیچیده شده(سقط جنین ، عفونت های ثانویه ، سپتی سمی ، جایگزینی در مجرای گوارشی . |
یافته های آزمایشگاهی:
روش های آزمایشگاهی به منظور تشخیص آبله در گوسفند و بز شامل جداسازی ویروس ؛ مشاهده مستقیم ویروس توسط ریزبین الکترونی ؛ تائید حضور پادتن با استفاده از خنثی سازی ویروس ؛ آزمون درخشندگی پادتنی غیر مستقیم و مشاهده ضایعات شاخص آسیب شناسی می باشد .آبله گوسفندی و بزی به جهت شکل ویژه در میان انواع ویروس های آبله ای بطور آزمایشی توسط ریزبین الکترونی قابل تمیز می باشند . بررسی های آسیب شناسی نیز می تواند در تشخیص بیماری سودمند باشد.ولی تشخیص قطعی با جداسازی عامل ویروسی محقق می شود . ویروس های آبله بزی و گوسفندی را می توان در بیضه بره ،کشت سلولی کلیه گوسفند و بز و همچنین در دیگر تیره های یاخته ای گوسفندی ، بزی و گاوی (با حساسیت کمتر) جدا نمود . مهار اثرات مرگ یاخته ای(CPE) ناشی از ویروس با استفاده از پادتن های ضد ویروسی در محیط کشت بطور فرضی در تعین عامل ویروسی موثر است . کاپریپاکس ویروس ها رامی توان با استفاده از روش درخشندگی ایمنی(ایمنوفلوسانس) یا رنگ آمیزی پر اکسیدازی ایمنی(ایمنوپراکسیداز)، شیوه های تشخیص اسید های هسته ای و دیگر فن آوری های تشخیصی حداقل تا سطح جنس ویروس معین نمود. در تحت برخی شرایط ویروس های فوق را می توان با تلقیح به گوسفند یا بز بازیافت کرد. ارزیابی با استفاده از واکنش پلیمریزاسیون زنجیری (PCR) می تواند جهت تفکیک ژنوم ویروسی درنمونه های بافتی یا کشت کارآمد باشد ولی نمی تواند نوع ویروس (بزی یا گوسفندی ) را مشخص کند . ولی با استفاده از روش RFLP[48] می توان این دو نوع ویروس را تمیز داد . بروز نوترکیبی بین این دونوع ویروس می تواند تشخیص ویروس را بغرنج کند .
پادگن های ویروسی را می توان در بافت ها با استفاده از روش انتشار ایمنی در ژل آکار(AGID) یا شیوه های متنوع ارزیابی جاذب ایمنی متصل به آنزیم (ELISAs) تعین نمود .الکتروفورزایمنی معکوس[49]، ترسیب ایمنی لاتکسی [50] و آزمون ترسیب ایمنی غیر مستقیم (انعقاد خونی غیر فعال فاز معکوس[51]، انعقاد ،انعقاد خونی غیر فعال و انعقاد نقطه ای [52]) را نیز می توان در تشخیص بکار برد . در آزمون انتشار ایمنی بر ژل آگار واکنش های متقاطع بین کاپریپاکس ویروس ها و پاراپاکس ویروس ها امکان پذیر است ولی به هر حال این دو دسته ویروس را می توان با استفاده از ریزبین الکترونی تمیز نمود . به لحاظ سرم شناختی می توان دو ویروس آبله بزی و گوسفندی را بعنوان کاپریپاکس ویروس تعین کرد ولی تمیز این دو از یکدیگر با روش فوق مکان پذیرنیست . پادتن های ضد کاپریپاکس ویروسی را حدوداً یک هفته پس از ظهور ضایعات پوستی می توان در سرم دام بیمار یافت .آزمون های سرم شناسی عبارتند از خنثی سازی ویروسی ، انتشار ایمنی در ژل آگار ، آزمون پادتن درخشان غیر مستقیم (IFA)[53] ، آزمون جاذب ایمنی متصل به آنزیم (ELISA) و لکه گذاری ایمنی [54]( Western blotting) . آزمون خنثی سازی ویروسی اختصاصی ترین آزمون سرم شناسی بوده اما از حساسیت کافی برای تعین دامهای آلوده برخوردار نیست .در آزمون های AGID و IFA امکان واکنش های متقاطه با دیگر ویروس ها وجود دارد .
پیش از جمع آوری یا ارسال هرگونه نمونه ای از دام های مشکوک به این بیماری ، بایستی مقامات مربوطه(سازمان دامپزشکی) را مطلع ساخت. برای جلوگیری از گسترش این بیماری نمونه ها تنها بایستی در تحت شرایط امن به آزمایشگاه های مجاز ارسال شوند. در دامهای زنده تکه برداری از ضایعات پوستی به منظور جداسازی ویروس وتعین پادگن انجام می شود . ویروس های آبله بزی و گوسفندی را می تواند در مایع تاولی ، دلمه ها و اجزای سائیده شده ضایعات پوستی ، همچنین آسپیره های حاصل از غدد لنفاوی و خون (تهیه شده در هپارین یا EDTA ) یافت . در هنگام کالبد گشائی نمونه های اخذ شده بایستی از ضایعات پوستی ، غدد لنفاوی و ضایعات ریوی جمع آوری گردند . همراه با این نمونه گیری یک سری دیگری از نمونه ها نیز بایستی برای آسیب شناسی تهیه شود ، نمونه های فوق بایستی در برگیرنده طیف گسترده ای از ضایعات پوستی ، همچنین طحال ، شکمبه ، نای ، ریه ها و دیگر بافت های درگیر باشند . با روش PCR می توان کاپریپاکس ویروس ها را در خون ، سوآب های تهیه شده از بینی یا دهان ، دلمه ها ، ضایعات پوستی و نمونه های بافتی تعین نمود . پادتن های خنثی ساز قادرند در جداسازی ویروس و برخی آزمون های تعین پادگنی ایجاد اختلال نمایند . لذا نمونه های مورد استفاده برای این آزمون بایستی در طی اولین هفته بیماری اخذ شوند. ولی نمونه های مورد استفاده برای PCR را می توان پس از تولید پادتن های خنثی گر تهیه کرد . برای ارزیابی های سرم شناسی بایستی یک زوج نمونه سرمی از دام اخذ گردد . نمونه مورد نظر برای جدا سازی ویروس را بایستی به فوریت ممکن برای آزمایشگاه ارسال نمود. این نمونه ها باید در مجاورت یخ ارسال گردند. اگر نمونه بایستی در مسافتی طولانی ارسال گردد و امکان خنک سازی وجود نداشته باشد می توان با افزودن گلیسرول 10٪ به نمونه آن را ارسال داشت . به منظور تشخیص آزمایشگاهی آبله گوسفندی وبزی تکه برداری پوستی از ضایعات اولیه جهت جداسازی ویروس و آسیب شناسی و بررسی با ریزبین الکترونی می تواند کارآمد باشد . نومونه های آسپیره شده از غدد لنفاوی متورم را می توان برای جدا سازی ویروس بکار برد . نمونه های کالبد گشائی بایستی شامل سری کاملی از بافت ها باشد اما نمونه های ریوی ، نائی و شکمبه ای واجد ضایعات بزگ به ویژه برای آسیب شناسی مناسب تر هستند . نمونه هائی که به منظور جداسازی ویروس اخذ می شوند بایستی در مجاورت یخ مرطوب به آزمایشگاه ارسال گردند . نمونه های مورد نظر برای آسیب شناسی بایستی در فرمالین بافری 10 درصد قرار گرفته و منجمد نشوند. نمونه های سرمی را بایستی از موارد حاد و مزمن اخذ نمود . اخذ مجدد نمونه سرمی از موارد حاد بایستی 2 تا 3 هفته پس از اولین نمونه برداری صورت گیرد .
خلاصه ای از نمونه ها و نمونه برداری.
|
خون هپارینه در طی مرحله تب برای جداسازی ویروس . سرم مرحله حاد و بهبودی برای ارزیابی های سرم شناسی. |
|
پوست و غددلنفاوی و تکه بردایها از ضایعات اولیه برای جداسازی ویروس ، آسیب شناسی و بررسی با ریزبین الکترونی |
|
نمونه های آسیب شناسی تهیه شده ازضایعات پوست ، ریه و نای بایستی در فرمالین بافری 10 ٪ بدون انجماد قرار گیرند و نمونه های سرمی و خون بایستی در مجاورت یخ باشند. |
|
تشخیص سریع با استفاده از ریزبین الکترونی امکان پذیر است . |
|
ویروس را می توان بر روی کشت سلولی کلیه بره جدا نمود که موجب تشکیل یاخته های شاخص مرضی آبله گوسفندی می شوند(sheeppox cell) و با ریزبین الکترونی و بطور هیستوپاتولوژی قابل تشخیص هستند . |
|
با استفاده از شیوه پاتن های درخشان بر روی بافت های منجمد می توان اثرات مرگ یاخته ای(CPE) را مشخص نمود . |
|
پادگن ویروسی را می توان با استفاده از آزمونهای انتشار ایمنی تعین کرد . |
|
پادتن های ویروسی را می توان با استفاده از آزمون های IFA, AGID و SNT مشخص نمود . |
یافته های کالبد گشائی:
در کالبد گشائی ضایعات پوستی دارای پرخونی ، خونریزی ، ادم ، التهاب عروقی و نکروز بوده و مشاهده می شود که تمامی لایه های اپیدرم ، درم و در موارد شدید بافت های عضلانی مجاور درگیر هستند .
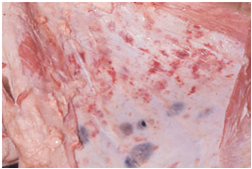
عقده های لنفاوی که بخشهای درگیر را زهکشی می کنند تا هشت برابر وضعیت معمول حجیم بوده و دارای تکثیر لنفوئیدی گسترده ، ادم ، پرخونی وخونریزی هستند . پوست معمولاً دارای لکه ها(ماکول) ، جوش ها (پاپول) و یا ضایعات نکروزه و دلمه هائی است که توسط نواحی آماسی ، دچار خون ریزی و پرخون احاطه شده . ممکن است در دام های زنده کالبد گشائی شده ضایعات پوستی تظاهر نداشته باشند . غشاهای مخاطی چشم ، دهان و بینی دارای ضایعات آبله ای است که در موارد شدید ممکن است در هم آمیخته باشند .همچنین غشاهای مخاطی چشم ، بینی ، دهان ،فرج و حشفه نیز ممکن است نکروزه و زخمی باشند . در موارد شدید آبله گوسفندی و بزی ممکن است بدلیل درگیری جدی که ناشی از ضایعات تکثیر شونده و التهابی است چشم بسته بماند . ضایعات روی پوزه و سوراخ های بینی ممکن است با هم یکی شده و تغییرات تکثیر شونده و التهابی گسترش یابند . ضایعات آبله ای ممکن است درحلق، زبان کوچک و نای بوجود آیند . ضایعات فوق معمولاً بصورت نواحی رنگ پریده مدوری محیط در یک ناحیه پرخون ظاهر می شوند . گاهی ممکن است ضایعات در بافت پوششی شکمبه و هزارلا پدیدار گردند . مخاط گلو ملتهب بوده و گاهی دچار خون ریزی است .
ضایعات آبله ای در ریه ها ممکن است شدید و گسترده باشند، ضایعات فوق بصورت کانونی و یکنواخت در طول ریه انتشار می یابند که خود ناشی از انتشار خونی ویروس است . پرده های پوشاننده ریه بر سطح خود خال های قرمز رنگ دارند . ضایعات اولیه ریه بصورت نواحی پرخون بوده که سپس با پیشرفت بیماری بصورت نواحی پرخون وآماسی پراکنده ای ظاهر شده و سرانجام تبدیل به گرهک های سفید می شوند . نواحی خلفی ضایعات آبله ای در ریه دچار آتلکتازی قطعچه ای هستند . عقده های لنفاوی میان سینه در غالب موارد تا پنج برابر وضع عادی متورم بوده و ممکن است پرخون ، دارای خونریزی و آماس باشند . ریه ها غالباً دارای نواحی پرخون ، آماسی یا یکپارچه سخت و گرهک های سخت خاگستری یا سفید هستند . گرهک ها در ریه تا قطر 5 سانتیمتر نیز می رسند و این گرهک ها را بویژه در قطعات دیافراگمی می شود دید .

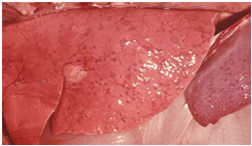
در مراحل نخست بیماری این ضایعات ممکن است بصورت خال دیده شوند . حفرات سینه ، کیسه قلبی و شکمبه حاوی مایع سرخ رنگ می باشد . لکه ها(پاپول) یا لکه های زخمی عموماً بر روی مخاط شیردانی موجود می باشند. ضایعات فوق را ممکن است بر روی شکمبه ، روده برگ ، حلق ، نای و مری نیز یافت .گاهی کانون های پراکنده رنگ پریده زیر کپسولی بر روی سطح کلیه، کبد و بیضه ها وجود دارند .
خلاصه ای ازکالبد گشائی ضایعات آبله ای در اندام های مختلف:
|
ضایعات پوستی: |
پرخونی ، خون ریزی، ادم ، التهاب عروقی و نکروز .تمامی لایه های اپیدرم ، درم و گاهی بافت های عضلانی مجاور درگیر هستند . |
|
غدد لنفاوی ناحیه: |
تورم ، تکثیر لنفوئید ، ادم ، پرخونی ، خونریزی . |
|
ضایعات آبله ای: |
بر روی پرده های مخاطی چشم ، دهان ، بینی ، حلق ، زبان کوچک،نای ، بر روی مخاطات شیردانی و شکمبه ای ، و بر روی پوزه ، سوراخ بینی ، در فرج ، حشفه ، بیضه ها ، پستان و سرپستانک ها . درموارد شدید ممکن است ضایعات در هم آمیخته و یکپارچه شوند. |
|
ضایعات ریوی: |
ضایعات حاد و گسترده بطور کانونی و یکنواخت در طول ریه پخش می شوند . پرخونی ، ادم ، نواحی کانونی تکثیر شونده توام با نکروز ، آتلکتازی قطعچه ای . تورم ، پرخونی ، ادم و خونریزی غدد لنفاوی میان سینه ای . |
تشخیص تفریقی:
بیماریهای متعددی هستند که در امر تشخیص ممکن است موجب اشتباهاتی شوند که عبارتند از :
1) بیماری زبان آبی(Bluetongue): دامهای درگیر افسرده بوده و التهاب ملتحمه در آنها غیر چرکی است . پوه متوم ، پرخون و آماسی است و در مواردی نیز التهاب نوارتاجی سم بروز می کند . گاهی جنین های ناهنجار یا نوزادان ناهنجار در گوسفندان و بزهای مبتلا سقط می شوند .
2) بیماری طاعون نشخوارکنندگان کوچک(Peste des Petits Ruminants): التهاب ملتحمه ، التهاب مخاطات بینی و ضایعات دهانی که سفید ، برآمده و نکروزه هستند عموماً مشهود می باشد . پنومونی ، اسهال و تلفات تاحدود 90٪ در بره و بزغاله های کمتر از یک ماه سن از شاخص ترین نشانه های بیماری است .
3) اکتیمای واگیر(Contagious Ecthyma) (التهاب پوستی دلمه ای مسری، بیماری اورف): بیماری فوق در بره و بزغاله ها از شدت بیشتری برخوردار است . ضایعات تکثیر شونده آبله ای عموماً بر روی پوزه و چشم نوزادان درگیر دیده می شوند . میزان تلفات ممکن است تا 50٪ برسد . میش ها و بز های ماده شیرده ممکن است دارای ضایعات تکثیر شونده برروی سرپستانک ها و پوزه باشند . این بیماری مشترک بین انسان و دام است . بروز ضایعات در افراد مراقب (دامداران، چوپانان و دامپزشکان) امر غیر معمولی نیست .
4) ازدیاد حساسیت نوری(Photosensitization) : نواحی التهابی خشک و فلسی شده محدود به بخش های غیر رنگدانه ای پوست می باشد .
5) گزش حشرات (Insect bites): ضربه حاصل از نیش حشره ممکن است موجب التهاب موضعی ، ادم و کهیر شود .ولی حشرات ندرتاً پرده های مخاطی را نیش می زنند .
6) پنومونی انگلی(Parasitic pneumonia): نشانه های حاد اختلال تنفسی ممکن است به همراه ضایعات انگلی گسترده بوجود آید . در چنین مواردی ضایعات آبله در پوست وجود ندارد.
7) التهاب غده لنفاوی پنیری(Caseous lymphadenitis): ضایعات برآمده کانونی در پوست که بصورت آبسه های پنیری تظاهر می کنند . چنین آبسه هائی را در آبله نمی شود دید.
8) استرپتوتریکوزیس(عفونت Dermatophilus congolensis): ضایعات در این بیماری سطحی بوده و غالباً مرطوب هستند . ضایعات عموماً در پوست ناحیه گردن ، ناحیه زیربغل ،ناحیه مغبنی و میان دوراه دیده می شوند . ارگانسیم عامل را می توان با رنگ آمیزی گیمسا مشاهده کرد .
9) ضایعات پوستی شبه دلمه ای جربی را در مورد آلودگی پوستی با جرب پزروپتیک می توان دید . خارش و خود تخریشی در موارد آبله گوسفندی وبزی دیده نمی شود .
جنبه های بهداشت عمومی:
هیچ گونه شاهد و اثباتی قطعی مبتنی بر انتقال آلودگی آبله بزی و گوسفندی به انسان وجود ندارد . یک مورد گزارش از هندوستان که کوشش داشت اثبات نماید که آبله بزی و گوسفندی به انسان قابل انتقال است صرفاً مبتنی بر نشانه های بالینی بوده و عامل ویروسی جدا نشده . هیچگون اقدامی در جهت بررسی سرم شناسی نیز بعمل نیامده . یک مورد گزاش نیز که در سوئیس بعمل آمده اگرچه با برسی های سرم شناسی ویروس واکسینا یا اکتیمای واگیر را منتفی دانسته ، ولی عامل ویروسی دیگری را نیز تعین نکرده . بنابر این با قاطعیت نمی توان گفت که ویروس آبله بزی و گوسفندی انسان را آلوده می سازد .
درمان بیماری:
این ناخوشی از دسته بیماریهای هشدار دهنده و گزارش کردنی بوده و درمان اختصاصی ندارد ، ولی استفاده از ترکیبات وسیع الطیف پادزیستی ممکن است تلفات ناشی از آلودگی های ثانویه را کاهش دهد. در موارد شدید بیماری درمان های حمایتی و علامتی اعمال می شود . اخیراً در خصوص داروهای ضد آبله ای شماری از راهکارها مورد ارزیابی و بررسی قرار گرفته . این بررسی ها متوجه ترکیبات مهار کننده ویروسی (مهار آنزیم های میزبانی) است که در سمت آنزیم های دخیل در همانند سازی DNA(مانند DNA پلی مراز) جهت دهی شده اند . این ترکیبات مهاری مشابه نوکلئوزید ها هستند ، بطوری که در خصوص هرپس ویروس ها اثرات ضد ویروسی آنها اثبات شده . با استفاده از این نوع ترکیبات بر علیه ویروس واکسینا و آبله گاوی اثرات ضد ویروسی آنها مشهود است .
کنترل و پیشگیری:
به احتمال زیاد منشاء آلودگی های کاپریپاکس ویروسی دامهای مبتلا می باشند ، اما اشیای آلوده و محصولات دامی چون پشم نیز می توانند موجب انتشار بیماری شوند . همه گیری های بیماری را می توان با اعمال قرنیطنه ، کنترل نقل و انتقالات دامی و کاهش جمعیت دامی آلوده و در معرض تماس ، ومتعاقباً پاکسازی و ضد عفونی کردن دامداری و تجهیزات مربوطه کنترل نمود . معدوم سازی درست لاشه های آلوده با اهمیت است ؛ در این خصوص سوزاندن لاشه یا مدفون ساختن آن در غالب موارد مفید می باشد . کاپریپاکس ویروس ها ممکن است تا 6 ماه درمحل های سایه دار، آغل های پاکسازی نشده و برای حداقل چند ماه در دلمه های پوستی ،پشم و مو پایدار باشند . ویروس های آبله نسبت به خشکی مقاوم می باشند و همچنین می توانند در چرخه انجماد/ذوب فعال بمانند ، اگرچه در طی این روند میزان عفونت زائی آن ها کاهش می یابد. زمانی که بیماری انتشار وسیعی دارد انجام مایه کوبی نیز می تواند مورد توجه باشد . بر اساس بررسی ها کاپریپاکس ویروس ها را با واسطه حرارت در دمای 56 درجه سانتی گراد درطی یک دوره زمانی 2 ساعته یا 65 در جه سانتی گراد در طی 30 دقیقه می توان از بین برد . حساسیت دمائی ممکن است در میان نژاد های مختلف کاپریپاکس ویروسی متفاوت باشد . عموماً کاپریپاکس ویروس ها نسبت به اتر(20٪)، فرمالین و کلروفرم حساس می باشند . همچنین گزارش هائی مبنی بر حساسیت در برابر هیپوکلریت سدیم ، پاک کننده هائی که حاوی حلال های چربی می باشند ، اسید کلریدریک (2٪ برای 15 دقیقه) ، اسید سولفوریک(2٪ برای 15 دقیقه) و فنل نیز وجود دارد . عفونت دام منجر به یک ایمنیت قوی خواهد بود و انجام مایه کوبی به منظور کنترل آبله گوسفندی و بزی در مناطق بومی قابل اجرای می باشد . در چنین مناطق بومی دامهای جدید بایستی پیش از ورود به گله در قرنطیه قرار گیرند . گله ها آلوده و دامهای بیمار را بایستی پس از رفع نشانه های بالینی حداقل تا 45 روز در قرنطینه قرار داد . در برخی از همه گیری ها تنها راه حذف گله مبتلا است .
انجام مایه کوبی در مناطق بومی یکی از موثر ترین شیوه های کنترلی در خصوص تلفات ناشی از آبله گوسفندی وبزی است . در تحت شرایط میدانی استفاده از واکسن کشته چندان مورد توجه نیست چراکه ایمنیت حاصله مستحکم و بادوام نیست . واکسن های زنده تخفیف حدت یافته متعددی به منظور محافظت از آبله گوسفندی و بزی تهیه شده . در این میان نژاد رومانی بطور گسترده ای مورد استفاده قرار می گیرد . واکسن های زند و غیر فعال امروزه برای برنامه های مایه کوبی بکار می روند . تمامی نژاد های کاپریپاکس ویروس در یک جایگاه خنثی سازی اصلی مشترک هستند و از این رو محافظت متقاطع دارند . واکسن های غیر فعال در بهترین وضعیت تنها یک ایمنیت کوتاه مدت را فراهم می سازند .
در صورت تائید وقوع مورد جدیدی از بیماری در یک منطقه جدید ، پیش از انتشار گسترده بیماری بایستی مبادرت به اعمال قرنطینه نمود ، دامهای آلوده و در معرض آلودگی بایستی حذف و کشتار گردند ، دامداری و متعلقات آن پاکسازی و ضدعفونی شود . مایه کوبی دام های پیرامون آن دامداری بایستی مورد توجه قرار گیرد . درصورتی که بیماری در منطقه گسترده تری منتشر گردد ، موثر ترین شیوه کنترلی در برابر خسارات ناشی از آبله گوسفندی و بزی انجام مایه کوبی است ، ولی به هر حال دقت های لازمه در خصوص حذف دامهای مبتلا و در معرض تماس بایستی اعمال شود ؛ حذف صحیح دامها و اشیای آلوده ؛ و پاکسازی دامداری و متعلقات آن ، تجهیزات و حصار های دامداری از راه کنترل بیماری است . در دامهای آلوده به ویروس آبله گوسفندی و بزی حالت ناقل وجود ندارد . ولی به هر حال ویروس قادر است برای ماه ها در دامداری و متعلقات آن بصورت فعال باقی بماند . لذا اعمال قرنطینه در مناطق و دامداری های دارای دامهای آلوده یا در معرض تماس از ضروریات ممانعت از انتشار بیماری است . در صورتی که انتشار بیماری محدود باشد می توان مبادرت به تخلیه گله های آلوده و در معرض تماس نمود .درصورتی که انتشار بیماری گسترده است مایه کوبی کلی و بدنبال آن قطع مایه کوبی و کنترل نقل و انتقال دام ها از مناطق آلوده راهکاری قدرتمندی جهت کنترل وسپس ریشه کنی بیماری است .
خلاصه ای از کنترل و پیشگیری
|
پیشگیری بهداشتی |
|
قرنطیه گله های آلوده و دام های بیمار حد اقل برای 45 روز پس از بهبودی . |
|
کشتار گله های آلوده (به سرعت ممکن ) . |
|
حذف درست و دقیق لاشه ها و محصولات دامی آلوده. |
|
ضدعفونی دقیق دامداری و متعلقات آن |
|
اعمال قرنطیه پیش از ورود دام های جدید به دامداری . |
|
کنترل نقل و انتقال دام و وسائل نقلیه . |
|
پیشگیری پزشکی |
|
انجام مایه کوبی . |
|
ایمنیت حاصله تا 2 سال دوام دارد. |
[1] rhinitis
[2] agroterrorism
[3] Surface tubules elements
[4] inverted terminal repeats
[5] extracellular enveloped virions
[6] intracellular mature virions
[7] epidermal growth factor
[8] lysomotropic
[9] promotors
[10] Virus growth factor
[11] Vaccina virus complement-binding protein
[12] Open reading frame
[13] Progeny virions
[14] Viroplasm
[15] self-priming
[16] concatemers
[17] cytoskeleton
[18] Spicule
[19] Microvilli
[20] A-type inclusion body
[21] Virus-occluding factor
[22] Eurasian Ruminant Street
[23] Transforming growth factor -α
[24] Vaccina virus growth factor
[25] Littoral cells
[26] Natural killer cell
[27] Polymorphonuclear nutrophils
[28] Chemoattractants
[29] Autacoids
[30] Ankyrin
[31] Integral membrane proteins
[32] Cytoskeletal elements
[33] Molluscum contagiosum virus
[34] Rounding
[35] Granulation
[36] Clumping
[37] Polykaryocytes
[38] Cytotoxic T lymphocytes
[39] Multiplicity of infection
[40] Cytotoxicity
[41] Antibady-dependent cell-mediated cytotoxicity
[42] Serin proteas inhibitors
[43] Vaccina virus complement binding protein
[44] prodromal
[45] erythematous
[46] papulovesicular
[47] stonepox
[48] restriction fragment length polymor-phism
[49] Counter-immunoelectrophoresis
[50] latex agglutination
[51] reverse-phase passive hemagglutina-tion
[53] indi-rect fluorescent antibody
[54] immunoblotting
